�|�_�Ɛ|�_�i�g���E���e�ʂ�����������A���_���������n�t��pH�@83���t���Ǝ�����16
��83���t���Ǝ����@��16
�݂��ɋ����ł���_���������Z�x�ȏ�܂ޗn�t�ɁA���ʂ̎_�≖�����������A���������Ĕ��߂��肵�Ă��A���̗n�t��pH�͑傫���ω����Ȃ��B���̂悤�ȗn�t��pH�ɏՉt�Ƃ����A�����̊W������B
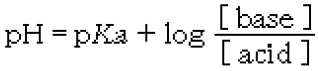
���̋L�qA�CB�́m�@a�@�n�m�@b�@�n�ɓ����ׂ����l��I�тȂ����B�������A�|�_��pKa=4.74�Ƃ���B
A�D�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������B�ł��߂�pH�́m a �n�ł���B
1�@3.74�@2�@4.74�@3�@5.74�@
B�DA�̗n�t100 mL��1.00 mol�^L ���_1.0 mL���������B�ł��߂�pH�́A�m b �n�ł���B
4�@3.65�@5�@4.65�@6�@4.83�@
��t���Ǝ����ߋ����W�@�Ȗڕʂ܂Ƃ߈ꗗ�@��
��t���Ǝ����ߋ����W�@�����@�_����t��pH�̌v�Z�@��
��83���t���Ǝ����@��16�@���
�n�t���݂̌��ɋ����ł���_(acid)�Ɖ���(base)�̑ɂ��āA���������藧�B
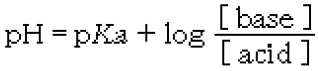
pKa�Ƃ͎_(acid)��pka�ł���B
������w���_�[�\���E�n�b�Z���o���q�̎��Ƃ����B�K���o���Ă������B
�Z�@A�ɂ���
�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������B�ł��߂�pH�́m a �n�ł���B
������2��4.74�ł���B
�_�ƂȂ镨���iHA�j�̓v���g���iH�{�j����o���ĉA�C�I���`�iA�F�|�j�ƂȂ�AA�F�|�̓v���g���������HA�ɂȂ�BA�F�|���_�iHA�j�̋�������ƌĂԁB
��_HA�Ƃ��̋�������A�|�����ꂼ�ꂠ��Z�x�ȏ�܂ޗn�t���ɏՉt�Ƃ����B
���̊ɏՉt�ł́A�_��������Ɖ���A�|�ɂ���Ē��a����A�����������Ǝ_HA�ɂ���Ē��a����邱�Ƃɂ��A�O������̎_�E����̗����ɑ���pH�̕ϓ���}�����p�i�ɏՍ�p�j�������B
���@��_HA�Ƃ��̋�������A�|�̃w���_�[�\���E�n�b�Z���o���q�̎�
��L�@�̉t�������AH3O�{��H�{�Ƃ݂Ȃ��ƁA
HA�̎_�𗣕��t�萔Ka��
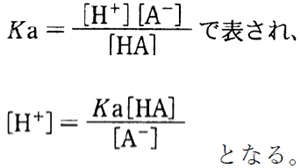
�����ŁA���ӂ̕��̏�p�ΐ��i�|log�j���Ƃ�ƁA
���������藧�B
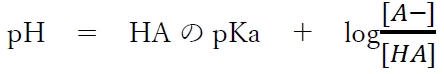
�������_HA�Ƃ��̋�������A�|�̃w���_�[�\���E�n�b�Z���o���q�̎��Ƃ����B
���̎��͎�_�Ƃ��̋�������̊ɏՉt��pH�̌v�Z���͂��߂Ƃ��āA�l�X�Ȍv�Z�ɗ��p�ł���ꍇ�������̂ŕK���o���Ă������B
��A�ł́A�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������n�t���쐬����Ă���B
�|�_�i�g���E���͋��d�����ł���A�����ł͂قƂ�Ǔd�����Ă���B
CH3COONa�@���@CH3COO�|�@�{�@Na+
����āA��A�̍����n�t�́A��_�ł���CH3COOH�Ƃ��̋��������CH3COO�|�̊ɏՉt�ł���B
��_HA�Ƃ��̋�������A�|�̃w���_�[�\���E�n�b�Z���o���q�̎����A�{��̍����n�t�ɂ��Ď��������藧�B
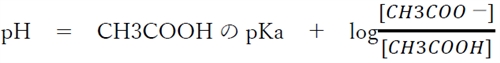
��蕶���A�u�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������v�Ƃ���̂ŁA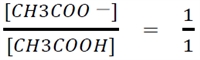
�ł���B
����āA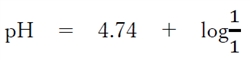
pH�@���@4.74
��ʂɁA
��_�Ƃ��̋�������̉�����Ȃ�ɏՉt�ɂ����āA
��_�̔Z�x�Ƃ��̋�������̔Z�x���������ꍇ�A
���f�C�I���Z�x����_��Ka
pH=pka
�����藧�B
���@�㉖��B�Ƃ��̋����_BH�{�̃w���_�[�\���E�n�b�Z���o���q�̎�
�㉖��B�F�Ƃ��̋����_BH+�����ꂼ�ꂠ��Z�x�ȏ�܂ޗn�t�����l�ɊɏՉt�ƂȂ�B
���̊ɏՉt�ł́A�_��������Ɖ���B�F�ɂ���Ē��a����A�����������Ǝ_BH+�ɂ���Ē��a����邱�Ƃɂ��A�O������̎_�E����̗����ɑ���pH�̕ϓ���}�����p�i�ɏՍ�p�j�������B
����B�F�̋����_BH+�͐����Ŏ��̂悤�ɉ𗣂���B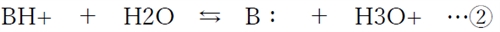
��L�A�̉t�������AH3O�{��H�{�Ƃ݂Ȃ��ƁA
����B�F�̋����_BH+�̎_�𗣕��t�萔Ka��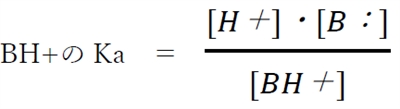
�ŕ\����A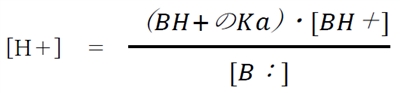
�����ŁA���ӂ̕��̏�p�ΐ��i�|log�j���Ƃ�ƁA
���������藧�B
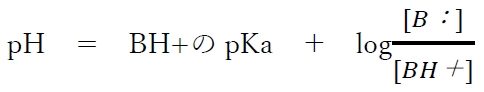
������㉖��B�Ƃ��̋����_BH�{�̃w���_�[�\���E�n�b�Z���o���q�̎��Ƃ����B
���̎��͎㉖��B�Ƃ��̋����_BH�{�̊ɏՉt��pH�̌v�Z���͂��߂Ƃ��āA�l�X�Ȍv�Z�ɗ��p�ł���ꍇ�������̂ŕK���o���Ă������B
�Z�@B�ɂ���
�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������n�t100 mL��1.00 mol�^L ���_1.0 mL���������B�ł��߂�pH�́A�m b �n�ł���B
������5��4.65�ł���B
A�̗n�t�ɉ��_��������ƁA����ł���CH3COO�|��HCl���琶������H�{�𒆘a���锽�����N����B
CH3COO�|�@�{�@Na+�@�{�@H+�@�{�@Cl�|�@���@CH3COOH�@�{�@NaCl
���_�̍����O��ɂ�����e�����̕����ʂ͉��L�̒ʂ�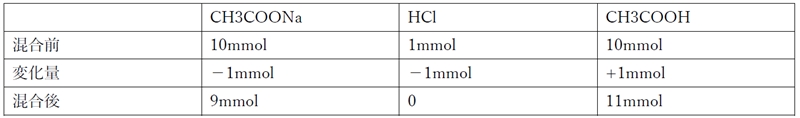
��_HA�Ƃ��̋�������A�|�̃w���_�[�\���E�n�b�Z���o���q�̎����A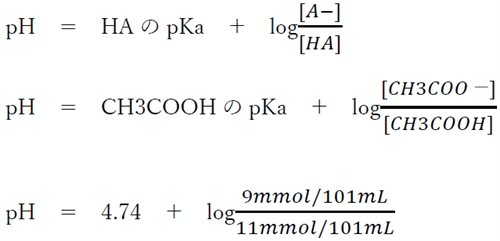
pH�@���@4.74�@�{�@log9�@�|�@log11
�{��ł�log9��log11�����Z����log�̒l���^�����Ă��Ȃ��̂�B��pH���Z�o���邱�Ƃ��ł��Ȃ��B
�������A�{��̗n�t�͊ɏՉt�ł���A���ʂ̎_���������Ă�������a�ɓ�����pH�͑傫���ϓ����Ȃ����Ƃ����Ă���ƁAA��pH��4.74��菭�����������l���Ɨ\�����邱�Ƃ��ł��A������4.65���ƍl������B
�Z�@�⑫
B�ł͊ɏՉt�Ɏ_���������ꍇ��pH�̕ϓ����l�����B
����ŁA�ɏՉt�ɉ�����������ꍇ�͂ǂ��Ȃ�̂��B
�|�_�Ɛ|�_�i�g���E���̊e�X0.200 mol�^L���n�t�e�ʂ����������n�t100 mL��1.00 mol�^L ���_���i�g���E���n�t1.0 mL���������ꍇ��z�肵�ApH�̕ϓ����l����B
A�̗n�t�ɐ��_���i�g���E���n�t��������ƁA�_�ł���CH3COOH��NaOH���琶������OH�|�𒆘a���锽�����N����B
CH3COOH�@�{�@Na+�@�{�@OH�|�@���@CH3COO�|�@�{�@Na+�@�{�@H2O
1.00 mol�^L ���_���i�g���E���n�t1.0 mL�̍����O��ɂ�����e�����̕����ʂ͉��L�̒ʂ�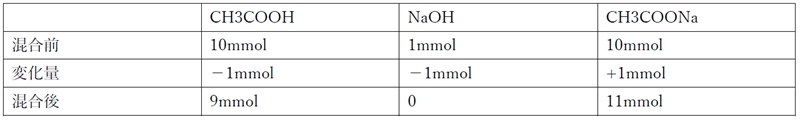
��_HA�Ƃ��̋�������A�|�̃w���_�[�\���E�n�b�Z���o���q�̎����A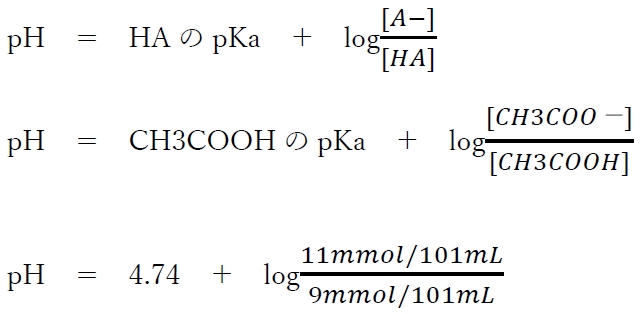
pH�@���@4.74�@�{�@log11�@�|�@log9
B��pH��4.65���Ƃ���ƁA���̏ꍇ��pH��4.83���ƍl������B
�{��̗n�t�͊ɏՉt�ł���A���ʂ̉���������Ă��_�����a�ɓ�����pH�͑傫���ϓ����Ȃ��B
���Q�l�O���T�C�g�����N
�_�E����̒�`�i�L�ł��킩��L�@���w����j
�_�E����̕��t�i�L�ł��킩��L�@���w����j