�㉖������ɂ�����pH�̕ω��ɑ���n��x�̕ω��@��w�@�����E���
�{�y�[�W�ł́A�㉖������ɂ�����pH�̕ω��ɑ���n��x�̕ω��ɂ��Đ������Ă��܂��B
��t���Ǝ����ߋ����W�@�Ȗڕʂ܂Ƃ߈ꗗ�@��
��t���Ǝ����ߋ����W�@�����@�_����t�@��
���@1���̎㉖������ɂ�����pH�̕ω��ɑ���n��x�̕ω�
�����̗n��x�Ƃ́A���̕����̈��ʂ̗n�}�ɗn������ő�ʂł���B�����̗n��x�́A���̕����̖O�a�n�t�ɂ�����S�Ẳ��w��̔Z�x�̑��a�ɓ������B
�n��x���O�a�n�t�ɂ�����S�Ẳ��w��̔Z�x�̑��a
�����̗n��x�ɂ��čl���鎞�́A�O�a�n�t��z�肷��B
���镨���̖O�a�n�t�Ƃ́A�n�}���ɗn���Ă��Ȃ����i�ő��j�����݂��A�Ȃ����A�n�t���������Ă���n�t�ł���A���̏�Ԃ̗n�t�̔Z�x��O�a�Z�x�Ƃ����i�ߖO�a�̎��������j�B
�����ŁA���q�`�ƃC�I���`��2��̉��w��ɂȂ蓾���d�����̗n��x�ɂ��ďq�ׂ�B�Ȃ��A�C�I���`�͑S�ėn��������̂Ƃ���B
�X�I�ɁA�O�a�n�t�ɂ����镪�q�`�̔Z�x�ƃC�I���`�̔Z�x�����ꂼ��m���q�`�n�O�C�m�C�I���`�n�O�ƕ\���Ƃ���B��������ƁA���̎�d�����̗n��x�ɂ��Ď������藧�B
��d�����̗n��x���@�m���q�`�n�O�@�{�@�m�C�I���`�n�O
��d�����̗n��x�͗n�t��pH�ɂ���ĕω�����B
��d�����̖O�a�n�t�ɂ����镪�q�`�̔Z�x�i�m���q�`�n�O�j��pH�ɂ���ĕω��������l�ł���B
����A��d�����̖O�a�n�t�ɂ�����C�I���`�̔Z�x�i�m�C�I���`�n�O�j��pH�ɂ���ĕω�����B
����āA��d�����̗n��x��pH�ɂ���ĕω�����̂́A�m�C�I���`�n�O��pH�ɂ���ĕω����邽�߂ł���B
�ȉ��ł́A�㉖������ɂ�����pH�̕ω��ɑ���n��x�̕ω��ɂ��ďq�ׂ�B
�Z�@1���̎㉖������̖O�a�n�t�ɂ�����pH�̕ω��ɑ��镪�q�`�Z�x�ƃC�I���`�Z�x�̕ϓ��ɂ���
�O�a�n�t�ł͗n�t���������Ă���B�n�t�Ƃ́A�n�}���̗n�����Ă��Ȃ������i�ő��j�Ɨn�����Ă�����̂Ƃ̊Ԃ̉��w���t�ł���B
��d�����̖O�a�n�t�ł́A����ɁA�n�����Ă��镪�q�`�ƃC�I���`�Ƃ̊ԂŎ_����t���������Ă���B
����āA1���̎㉖������̖O�a�n�t�ł͉��L�̇@�ƇA��2�̉��w���t���������Ă���B
����1���̎㉖�������B�F�i���q�`�j��BH+�i�z�C�I���`�j��2��̉��w��ɂȂ蓾��Ƃ���B
�@�@�n�t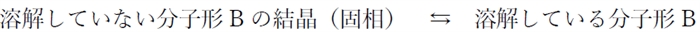
���̗n�t�ő厖�Ȃ��Ƃ́A�ő��̗ʂɂ�炸�ő������݂������ApH���ω����Ă��n�����Ă��镪�q�`�̔Z�x�͈��l�ɕۂ����Ƃ������Ƃł���B
�㉖������̖O�a�n�t�ł́A�n�����Ă��镪�q�`B�̔Z�x�i�mB�n�O�j��pH�ɂ���ĕω��������l�ł��邱�Ƃ��������Ă������B
�A�@�_����t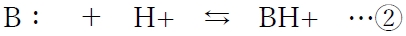
�E1���̎㉖������̖O�a�n�t�̕��t�̃C���[�W

�㉖������̖O�a�n�t�ɂ����āA�n�t�̂��߂ɕ��q�`B�̔Z�x�i�mB�n�O�j��pH�ɂ���ĕω��������l�ł��邱�Ƃ��ŏq�ׂ��B
����A�㉖������̖O�a�n�t�ɂ�����z�C�I���`BH+�̔Z�x�i�mBH+�n�O�j��pH�ɂ���ĕω�����B
�A�̎_����t���ApH���㏸����Ηz�C�I���`BH+�̔Z�x�͒ቺ���ApH���ቺ����Ηz�C�I���`BH+�̔Z�x�͏㏸����B
�㉖������̗n��x��pH�ɂ���ĕω�����̂́A�O�a�n�t�ɂ�����z�C�I���`BH+�Z�x�i�mBH+�n�O�j��pH�ɂ���ĕω����邽�߂ł���B
�����ŁA�㉖������̖O�a�n�t�ɂ�����pH�̕ω��ɑ��ėz�C�I���`BH+�Z�x�i�mBH+�n�O�j���ǂ̂悤�ɕω�����̂��ɂ��Đ�������B
����㉖������͎��̂悤�ɉ𗣂��AB�F��BH+��2��̉��w��ɂȂ蓾��Ƃ���B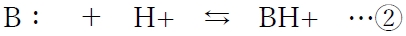
�A�̎_����t�ɂ����āA�㉖������̃w���_�[�\���E�n�b�Z���o���q�̎��Ƃ��Ď��������藧�B
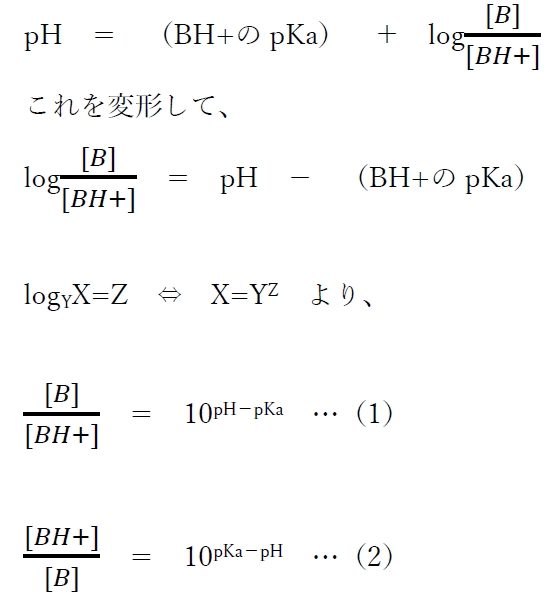
�i1�j���܂��́i2�j�����A�㉖������̂���pH�ɂ����镪�q�`�Z�x�Ɨz�C�I���`�Z�x�̔䂪�v�Z�ł���B
�i2�j���ɂ����āA�mB�n��1�Ƃ���ƁA

�i3�j�����A�㉖������̂���pH�ɂ����镪�q�`�Z�x���P�Ƃ����Ƃ��̗z�C�I���`�Z�x�̑Δ䂪�v�Z�ł���B
�i3�j�����A�㉖������̖O�a�n�t�ɂ����āApH�̕ω��ɑ��ėz�C�I���`�Z�x�i�mBH+�n�O�j���ǂ̂悤�ɕω�����̂����͂߂�B
���̂悤�ɁA�㉖������̖O�a�n�t�ł�pH�̕ω��ɑ��ėz�C�I���`�Z�x�i�mBH+�n�O�j���ω�����̂ŁA�㉖������ł�pH�̕ω��ɑ��ėn��x���ω�����B
����1���̎㉖������ɂ�����pH�̕ω��ɑ���n��x�̕ω��ɂ��āA
pH=pKa�|1
pH=pKa
pH=pKa�{1�@
�Ƃ���3��pH���ɂ��āA1���̎㉖������̖O�a�n�t�̃C���[�W�}�����Ɏ����B
�EpH=pKa�|1�@�̎�
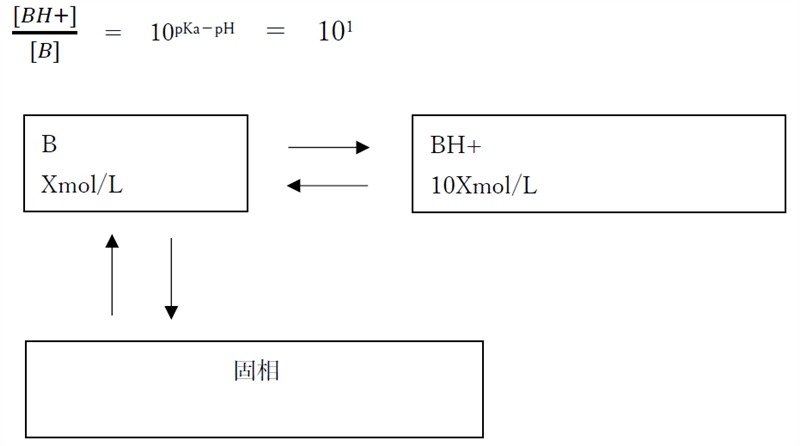
�EpH=pKa�@�̎�
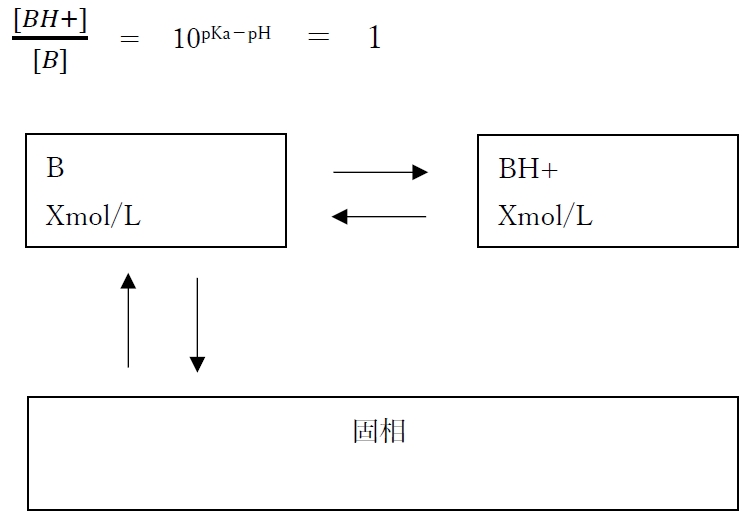
�EpH=pKa�{1�@�̎�
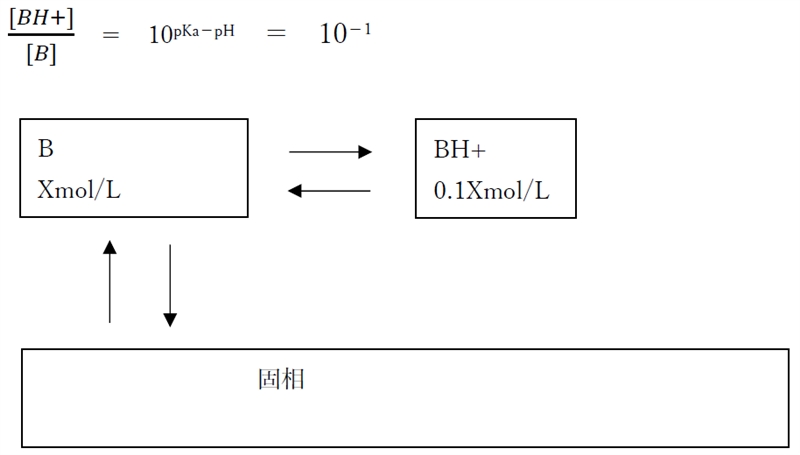
�㉖������̖O�a�n�t�ł�pH���ω����Ă����q�`�Z�x�͈��ł��邱�Ƃɒ��ӂ���B
�ȏ���A
�㉖��̖O�a�n�t�ɂ����āApH�̕ω��ɑ���e���w��̔Z�x�̕ω��ɂ��āA���̂��Ƃ�������B
�EpH���ቺ�����ꍇ
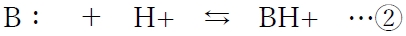
�̕��t���E�ɌX���AB����BH+�ɕς�锽�������i�����B
�z�C�I���`�Z�x�i�mBH+�n�O�j��pH��1�ቺ���邲�Ƃ�10�{�ɏ㏸����B
���q�`�Z�x�i�mB�n�O�j�ɂ��āApH�ቺ�ŕ��q�`�iB�j�����肻���ɂȂ邪�A�O�a�n�t�ł͗n�t�Ōő�����B���n���������ƂŁA�n�����Ă���B�͈��ʂɕۂ���邽�߁A���q�`�Z�x�i�mB�n�O�j��pH�ɂ�炸���ł���B
�EpH���㏸�����ꍇ
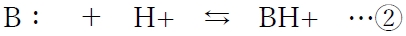
�̕��t�����ɌX���ABH+����B�ɕς�锽�������i�����B
�z�C�I���`�Z�x�i�mBH+�n�O�j��pH��1�㏸���邲�Ƃ�1/10�ɒቺ����B
���q�`�Z�x�i�mB�n�O�j�ɂ��āApH�㏸�ŕ��q�`�iB�j�����������ɂȂ邪�A�O�a�n�t�ł͗n�t�Ōő��ɂȂ�B�������邱�ƂŁA�n�����Ă���B�͈��ʂɕۂ���邽�߁A���q�`�Z�x�i�mB�n�O�j��pH�ɂ�炸���ł���B
�Z�@�㉖������̂���pH�ɂ�����n��x�̌v�Z���@
�ȏ�͕��q�`B�Ɨz�C�I���`BH+��2��̉��w����Ƃ蓾��㉖������ɂ����āApH�̕ω��ɑ��ėn��x���ǂ̂悤�ɕω����邩�̐����ł������B
�ȉ��ł́A1���̎㉖������̂���pH�ɂ�����n��x�̌v�Z���@���������B
�㉖����������̇A�̂悤�ɉ𗣂���Ƃ���B
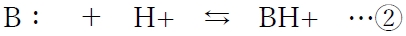
1���̎㉖������̗n��x�͖O�a�n�t�ɂ����镪�q�`�Z�x�i�mB�n�O�j�Ɨz�C�I���`�Z�x�i�mBH+�n�O�j�̘a�ɓ������B
1���̎�d�����̗n��x���@�m���q�`�n�O�@�{�@�m�C�I���`�n�O
1���̎㉖�������̗n��x���@�mB�n�O�@�{�@�mBH+�n�O
����pH�ɂ�����n��x���v�Z�ł���悤�ɂ��邽�߂ɁA
���̎������ɂ��āupH�v�̕ϐ����o�������邽�߂ɕό`���Ă����B
�܂��́A�mBH�{�n�O��ϊ�����B
�A���ABH+�̎_�𗣒萔Ka�ɂ��Ď������藧�B

����āA�������藧�B
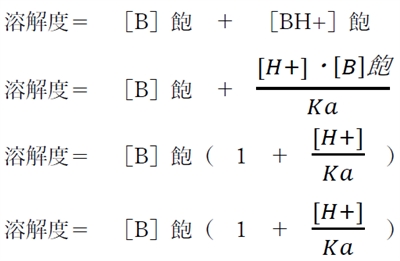
�����ŁA
pH=�|log[H+]�@���@�|pH=log[H+]
�����
pKa=�|logKa�@���@�|pKa=logKa
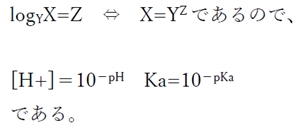

�i4�j���ɂ��A�㉖������̂���pH�ɂ�����n��x���v�Z�ł���B
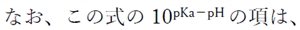
�㉖������̖O�a�n�t�ɂ����镪�q�`�Z�x��1�Ƃ����Ƃ��̃C�I���`�Z�x�̑Δ�ł���B���ꂪpH�ɂ���ĕω�����̂Ŏ㉖������̗n��x��pH�ɂ���ĕω�����B
�i4�j����p���āA
1���̎㉖������̗n��x�ɂ��āA
pH���A
pKa�|2�C
pKa�|1�C
pKa�C
pKa�{1�C
pKa�{2�@
�̎��̒l���ǂ��Ȃ邩�v�Z����B
�EpH��pKa�|2�̎��̗n��x

�EpH��pKa�|1�̎��̗n��x

�EpH��pKa�̎��̗n��x

�EpH��pKa�{1�̎��̗n��x

�EpH��pKa�{2�̎��̗n��x

�ȏ���A
1���̎㉖��̗n��x�ɂ��āA
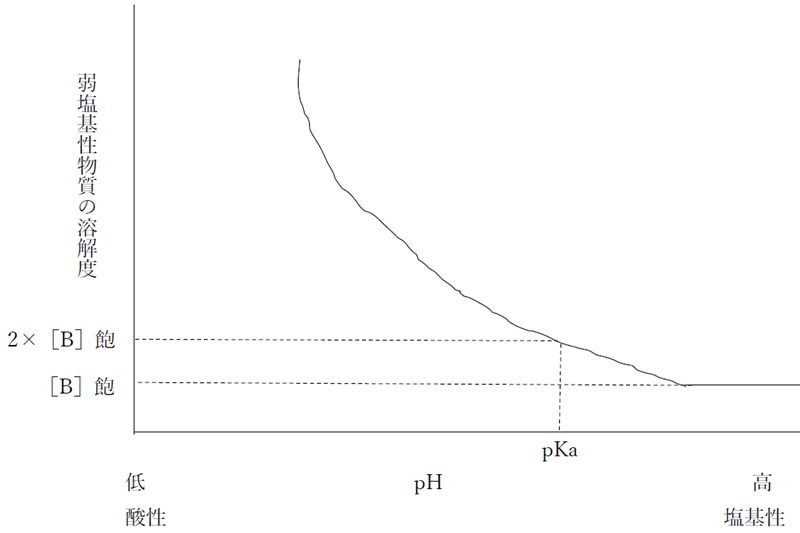
pH��pKa�Ɠ������ꍇ�̗n��x�́g2�~�mHA�n�O�h�ɓ������Ƃ݂Ȃ��A
pH��pKa���2�ȏ㍂���ꍇ�ipH��pKa�{2�j�̗n��x�́mB�n�O�ɂقړ������Ƃ݂Ȃ���B
���}��1���̎㉖������ɂ�����n�t��pH�Ɨn��x�̊W�������Ȑ��ł���B
�{�y�[�W�ł́A1���̎㉖��������ɂ�����pH�̕ω��ɑ���n��x�ɂ��ĉ�������B
�ʃy�[�W�ŁA1���̎�_���������ɂ�����pH�̕ω��ɑ���n��x�̕ω��ɂ��ĉ�����Ă���̂ŁA
��������Q�Ƃ��Ă������������B
��_�������ɂ�����pH�̕ω��ɑ���n��x�̕ω��@��
���Q�l�O���T�C�g�����N
pH����щ𗣒萔�iyakugaku lab����j