弱酸性薬物水溶液の分子形・イオン形薬物分率と溶解度 99回薬剤師国家試験問174
第99回薬剤師国家試験 問174
pKa=5.2の1価の弱酸性薬物水溶液に関する下記の記述のうち、正しいのはどれか。1つ選びなさい。
ただし、イオン形薬物はすべて溶解するものとする。
1 pH 5.2の溶液中では、分子形の薬物のみが存在する。
2 pH 7.2の溶液中では、イオン形薬物分率は約1%である。
3 pH 6.2における溶解度は、pH 5.2と比較して約10倍である。
4 pH 7.2における溶解度は、pH 5.2と比較して約50倍である。
5 pH 7.2における溶解度は、pH 5.2と比較して約100倍である。
第99回薬剤師国家試験 問174 解答解説
正解は4である。
「4 pH 7.2における溶解度は、pH 5.2と比較して約50倍である。」
選択肢1,2は1価の弱酸性物質におけるpHの変化に対する各化学種の存在割合(存在比)の変化についての問題である。
選択肢3,4,5は1価の弱酸性物質におけるpHの変化に対する溶解度の変化についての問題である。
◆ 選択肢1,2について
弱酸性薬物におけるpHの変化に対する各化学種(分子形・イオン形)の存在割合(存在比・分率)の変化についての問題である。
弱酸性物質におけるpHの変化に対する分子形・イオン形の存在比の変化の解説 へ
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取って分子形(HA)になる。A:−を酸(HA)の共役塩基と呼ぶ。
上記の酸塩基平衡を基に、
弱酸性物質について、溶液のpH,HAのpKa,分子形濃度[HA],イオン形濃度[A−]の関係式として、
次のヘンダーソン・ハッセルバルヒの式が成り立つ。

これを変形すると、
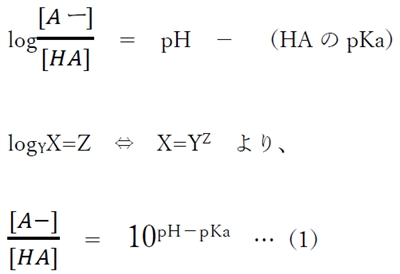
(1)式より、弱酸性物質のあるpHにおけるHA(分子形)とA−(陰イオン形)の存在割合(存在比)を計算できる。
以上を参考に、選択肢1及び2の記述について解説する。
◆ 1の記述について
1 × pH 5.2の溶液中では、分子形の薬物のみが存在する。
→ 〇 pH 5.2の溶液中では、分子形の薬物とイオン形の薬物が存在割合で50%ずつ、存在比1:1で存在する。
本問は、pKa=5.2の1価の弱酸性薬物水溶液に関する問題である。
(1)式に、pKa=5.2,pH=5.2 を代入すると、
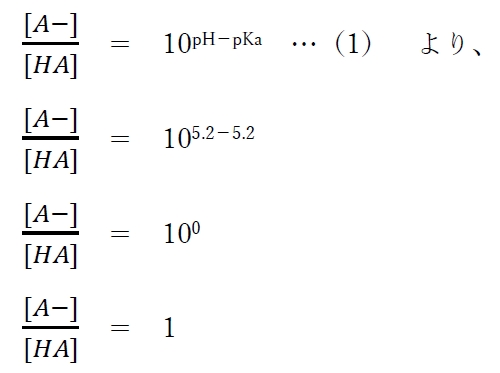
よって、本問の弱酸性薬物について、
溶液のpH=pKa=5.2の時、
分子形(HA)と陰イオン形(A−)の存在比が1:1となり、分子形(HA)と陰イオン形(A−)が存在割合として50%ずつで存在している。
このように、1価の弱酸性物質においては、
溶液のpHがpKaと等しい時、分子形(HA)と陰イオン形(A−)の存在割合が50%ずつとなる(分子形とイオン形の存在比が1:1となる)。
◆ 2の記述について
2 × pH 7.2の溶液中では、イオン形薬物分率は約1%である。
→ 〇 pH 7.2の溶液中では、イオン形薬物分率は約99%である。
(1)式に、pKa=5.2,pH=7.2 を代入すると、

よって、本問の弱酸性薬物について、
溶液のpH= 7.2の時、
分子形(HA)と陰イオン形(A−)の存在比が
HA:A− = 1:100 となる。

ちなみに、本問の弱酸性薬物について、
pH=3.2の時の分子形(HA)とイオン形(A−)の分率は下記のようになる。

よって、本問の弱酸性薬物について、
溶液のpH= 3.2の時、
分子形(HA)と陰イオン形(A−)の存在比が
HA:A− = 100:1 となる。

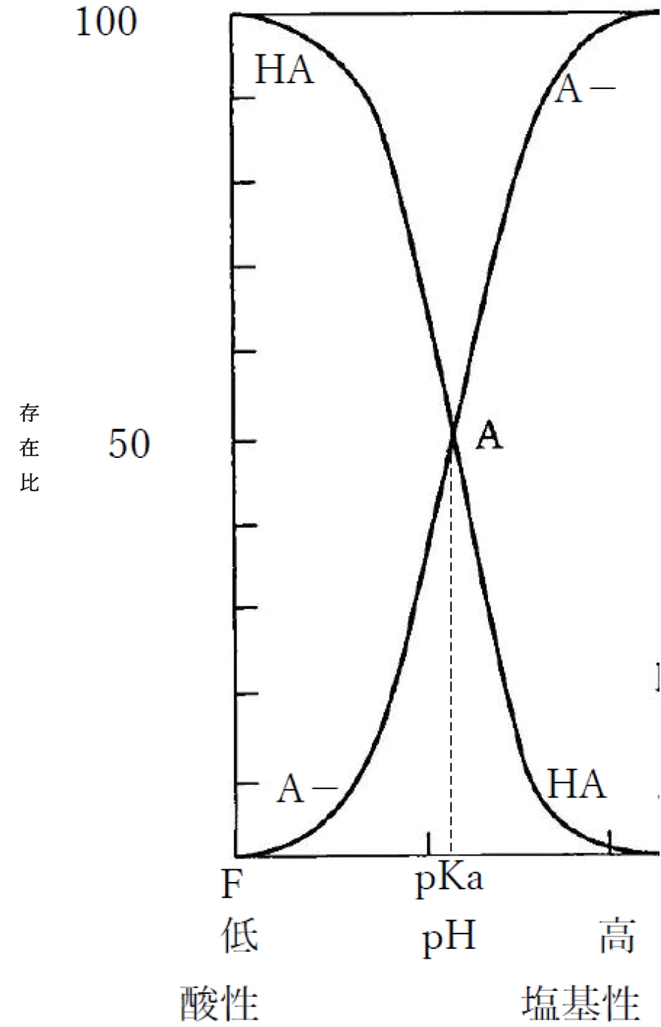
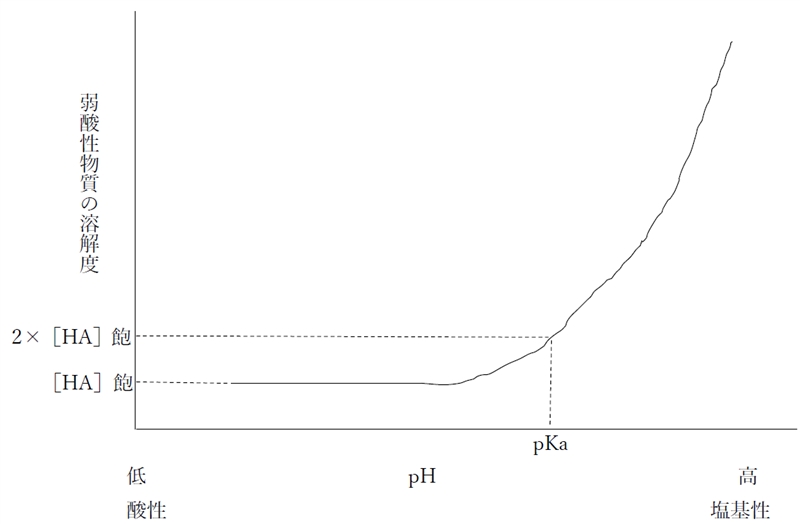
下図は溶液のpHと1価の弱酸性物質の分子形(HA)および陰イオン形(A−)の存在割合の関係を示す曲線である。
◆ 選択肢3,4,5について
1価の弱酸性化合物におけるpHの変化対する溶解度の変化についての問題である。
弱酸性物質におけるpHの変化に対する溶解度の変化の解説 へ
物質の溶解度は、その物質の飽和溶液における全ての化学種の濃度の総和に等しい。
よって、物質の溶解度について考える時は、飽和溶液を想定する。
・1価の弱酸性物質の飽和溶液の平衡のイメージ

1価の弱電解質の飽和溶液における分子形の濃度とイオン形の濃度を
それぞれ[分子形]飽,[イオン形]飽と表すとすると、1価の弱電解質の溶解度について次式が成り立つ。
1価の弱電解質の溶解度 = [分子形]飽 + [イオン形]飽
上式より、
下記の1価の弱酸性物質の溶解度とpH,pkaの関係式が導かれる。
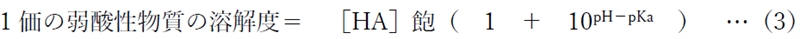
式中の[HA]飽とは、弱酸性物質の分子形の飽和濃度である。
本問では、pKa=5.2の1価の弱酸性薬物の溶解度について、
pH5.2,pH6.2,pH7.2の時の溶解度を比較する。
(3)式を用いて各pHでの溶解度を計算する。
なお、飽和溶液における分子形の濃度([HA]飽)はpHによらず一定値である。
〇 pH=5.2の時の溶解度

1価の弱酸性物質では、pH=pKaの時、分子形HAと陰イオン形A−の存在割合が50%ずつとなる(分子形とイオン形の存在比が1:1となる)。
よって、1価の弱酸性物質では、pH=pKaの時、分子形濃度とイオン形濃度が等しくなる。
したがって、1価の弱酸性物質では、pH=pKaの時、溶解度は飽和溶液における分子形の濃度([HA]飽)の2倍の値に等しいといえる。
〇 pH=6.2の時の溶解度

〇 pH=7.2の時の溶解度

1価の弱酸性物質の飽和溶液においては、分子形の濃度([HA]飽)はpHによらず一定値である。
一方、1価の弱酸性物質の飽和溶液におけるイオン形の濃度は、pHが1上昇するごとに10倍になる、または、pHが1低下するごとに1/10になる。
このようにして1価の弱酸性物質の溶解度はpHによって変化する。
下図は1価の弱酸性物質における溶液のpHと溶解度の関係を示す曲線である。
◆ 問題の3の解答
3 × pH 6.2における溶解度は、pH 5.2と比較して約10倍である。
問題の3の記述では、pH 6.2における溶解度はpH 5.2と比較して約何倍かが問われている。
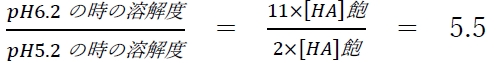
よって、pH 6.2における溶解度はpH 5.2と比較して約5.5倍である。
◆ 問題の4,5の記述の解答
4 〇 pH 7.2における溶解度は、pH 5.2と比較して約50倍である。
5 × pH 7.2における溶解度は、pH 5.2と比較して約100倍である。
問題の4,5の記述では、pH 7.2における溶解度はpH 5.2と比較して約何倍かが問われている。
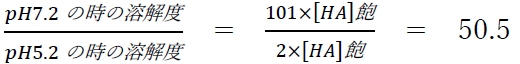
よって、pH 7.2における溶解度はpH 5.2と比較して約50倍である。
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)
★他サイトさんの解説へのリンク
99回問174(e-RECさん)