酢酸と酢酸ナトリウムからなる緩衝液のpH 87回薬剤師国家試験問30
第87回薬剤師国家試験 問30
弱酸HAとそのナトリウム塩NaAからなる緩衝溶液中では,次の平衡が成り立っている。
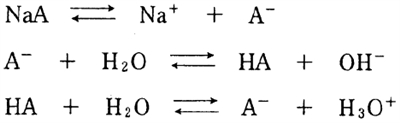
NaAが強電解質である場合には,完全に解離しているため,A−の濃度[A−]は塩の全濃度CBに等しく,また,弱酸の濃度[HA]は弱酸の全濃度CAに等しいとみなすことができる。
H3O+をH+とみなし,弱酸の解離平衡定数をKaとすると,
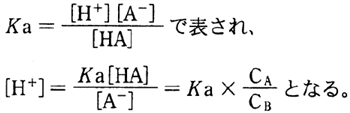

1 3.0 2 4.0 3 4.5
4 5.0 5 5.5
第87回薬剤師国家試験 問30 解答解説
正解は4のpH=5.0である。
ある弱酸HAとその共役塩基の塩からなる緩衝液の水素イオン濃度の計算について、
本問のように弱酸の酸解離定数Kaの定義式より、それを改変して水素イオン濃度が求められる。
弱酸HAは水中で次のように解離している。
A−を弱酸HAの共役塩基と呼ぶ。
上記の可逆反応より、H3O+をH+とみなすと、
HAの酸解離平衡定数Kaは
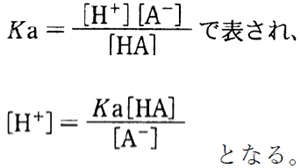
本問では、酢酸とその共役塩基の塩である酢酸ナトリウムからなる緩衝液のpHを求める。
この緩衝液の水素イオン濃度について次式が成り立つ。
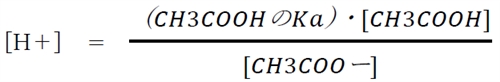
酢酸ナトリウムは強電解質であり、水中でほとんど電離している。
CH3COONa → CH3COO− + Na
よって、酢酸イオンの濃度は酢酸ナトリウムの全濃度に等しいとみなせる。
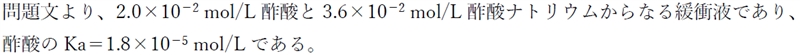
以上のことから、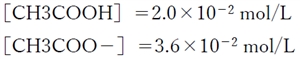
である。
したがって、この緩衝液の水素イオン濃度は、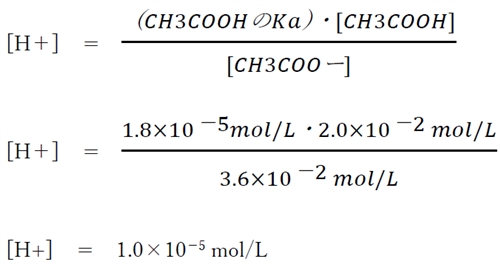
pH=−log[H+] より、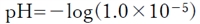
pH=5
〇 酸解離定数Kaの定義式から導かれる弱酸のヘンダーソン・ハッセルバルヒの式
弱酸HAは水中で次のように解離している。
A−を弱酸HAの共役塩基と呼ぶ。
上記の可逆反応より、H3O+をH+とみなすと、
HAの酸解離平衡定数Kaは
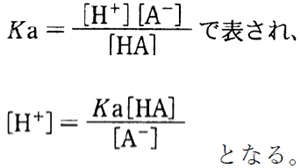
ここで、両辺の負の常用対数(−log)をとると、
次式が成り立つ。
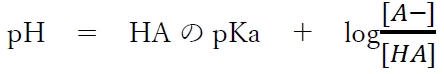
これを弱酸HAとその共役塩基A−のヘンダーソン・ハッセルバルヒの式という。
この式は弱酸とその共役塩基の塩の緩衝液のpHの計算をはじめとして、様々な計算に利用できる場合が多いので必ず覚えておこう。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)