化学電池の放電の酸化還元反応とギブズ自由エネルギー変化 薬学
本ページでは、化学電池の放電の酸化還元反応とギブズ自由エネルギー変化について解説しています。
☆ 化学電池の放電の酸化還元反応とギブズ自由エネルギー変化
ギブズ自由エネルギーの減少量は、定温定圧下、系から取り出すことのできる膨張以外の有用な仕事の最大値に等しい。膨張以外の有用な仕事の例として、電気的な仕事がある。
また、系から取り出される有用な仕事が最大となるのは変化が可逆過程で進む場合であり、不可逆過程では損失が発生する。
化学電池の放電は、定温定圧下、可逆過程に近い条件下で行われるとみなせる。
よって、化学電池の放電から取り出すことのできる有用な仕事はギブズエネルギー変化に等しいとみなせる。
☆ 電極電位と電子の流れ
以下の(酸化体1/還元体1)系と(酸化体2/還元体2)系という2つの酸化還元反応系が組み合わさって化学電池が作られることを考える。
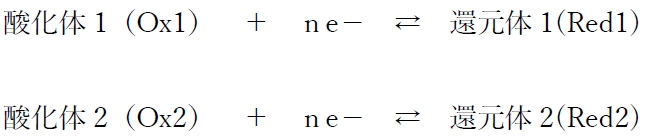
(酸化体1/還元体1)系の酸化還元電位をE1、
(酸化体2/還元体2)系の酸化還元電位をE2とし、
E1>E2 であるとする。
電子のエネルギーは電位が低いほど高いため、
自発反応では、電子は電位が低い方から高い方へと流れる。
よって、(酸化体1/還元体1)系と(酸化体2/還元体2)系から成る化学電池において、各電極では次のことが起こる。
電位が相対的に高い(酸化体1/還元体1)系では、
酸化体1(Ox1) + ne- → 還元体1(Red1)
という還元反応に反応が偏り電子が流入し、正極(カソード)となる。
電位が相対的に低い(酸化体2/還元体2)系では、
還元体2(Red2) → 酸化体2(Ox2) + ne-
という酸化反応に反応が偏り電子が流出し、負極(アノード)となる。
全電池反応は下記の反応に偏る。
酸化体1 + 還元体2 → 還元体1 + 酸化体2
電流(正電荷の流れ)の向きは電子の流れとは反対方向の正極→負極である。
☆ 化学電池の仕事の概要
以下では、(酸化体1/還元体1)系と(酸化体2/還元体2)系から成る化学電池が放電することにより発生する電気的な仕事について述べる。
電圧とは電気の流れを生む要因である。
電池とは電圧として電位差を作り出すことにより電子の流れと電流を生じさせるものを指し、結果として、電池は電気的な仕事を発生させる。
電池からは、電気がする仕事として、電荷を電位差だけ移動させる分に相当する仕事を取り出すことができる。
電気がする仕事は電力量で表される。
電気がする仕事(電力量)について、
1C(クーロン)の電気量を1V(ボルト)の電位差だけ移動させる仕事(電力量)を1J(1C・V)とし、J=C・Vが成り立つ。
1Cは1秒間に1A(アンペア)の電流で運ばれる電荷に相当する電気量である。
よって、電力量(電気がする仕事)について次式が成り立つ。
電力量(J) = 電気量(C) × 電圧(V)
電池では、電圧=両極間の電位差 なので、
電力量(J) = 電気量(C) × 電位差(V)
☆ 化学電池の起電力
電池における電流の駆動力を起電力とも呼ぶ。
化学電池の起電力は両電極間の電位差(電圧)である。
電池において、両極間の電位差または起電力は次式で計算される。
化学電池の起電力 = (正極の電極電位) - (負極の電極電位)
化学電池の起電力(電流の駆動力)は電位差(電圧)に等しいので、
電池の電力量について次式が成り立つ。
電力量(J) = 電気量(C) × 起電力(V)
☆ 化学電池の電気量
化学電池における電気量とは、酸化還元反応に伴い両電極間を移動する電荷の総量である。
電子や陽子1molあたりの電荷(電気量)をファラデー定数Fといい、F=96485(C/mol)とされている。
よって、電池でnmolの電子が負極から正極へ流れることについて、両電極間を移動する電荷の総量(電気量)は、n(mol)×Fである。
☆ 化学電池の仕事の計算
以上より、化学電池において、
nmolの電子が負極から正極へ流れることで発生する電気化学的仕事(電力量)は次式で計算できる。
電気化学的仕事(電力量)をw、電位差または起電力をEとおくと、
電力量(J) = 電気量(C) × 起電力(V)
より、
w = nmol×F × E
☆ 有用な仕事とギブズエネルギーの変化の値の符号(正,負)
系のエネルギーの変化とエネルギーを表す状態関数の変化量の符号の付け方は下記の通り。
・系が外界に対して仕事を行う、または、系が外界に対して熱を放出する等、系のエネルギーが低下する場合、系のエネルギーを表す状態関数の変化量の値は負(―)で表される。
・系に対して仕事が加えられる、または、系に対して熱が加えられる等、系のエネルギーが上昇する場合、系のエネルギーを表す状態関数の変化量の値は正で表される。
このことから、
系である化学電池が放電して外界に対して電気的な仕事を行い、系のエネルギーが低下する場合、そのギブズエネルギー変化の値は負(―)で表す。
一方、系である化学電池が充電され、系のエネルギーが上昇する場合、そのギブズエネルギー変化の値は正で表す。
よって、化学電池の放電の酸化還元反応でnmolの電子が流れる場合、電池から取り出される仕事(w)と系のギブズエネルギー変化(⊿G)について、次式が成り立つ。なお、電位差または起電力をEとおく。
⊿G = -w
⊿G = -(n・F・E)