酸化還元平衡での酸化還元電位と電池の起電力
本ページでは、酸化還元平衡での酸化還元電位と電池の起電力について説明しています。
☆ 酸化還元平衡での酸化還元電位と起電力
下記の(1)(2)の2つの半反応と、
それらの組み合わせから成る(3)の酸化還元反応について、
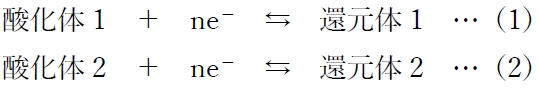
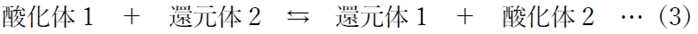
自発反応では、酸化還元電位の低い反応系から高い反応系へと電子が流れる。
2つの反応系の電位差が無くなると見かけ上電子の流れは止まる。
(1)(2)の電位をそれぞれE1,E2とすると、
2つの半反応の酸化還元電位の差が無くなり(E1−E2=0)、
E1とE2が等しくなる時(E1=E2)、
(3)は見かけ上反応が止まり、平衡状態に達する。
また、(1)(2)の2つの半電池からなる電池では、
電池の起電力=E1−E2 であるが、
酸化還元反応の平衡状態では、
E1=E2 より、
電池の起電力は0となる。