弱酸性物質におけるpHの変化に対する分子形・イオン形の存在比(分率)の変化
本ページでは、弱酸性物質におけるpHの変化に対する分子形とイオン形の存在比(分率)の変化について解説しています。
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:-)となり、A:-はプロトンを受け取ってHAになる。A:-を酸(HA)の共役塩基と呼ぶ。
上記①の酸HAと共役塩基A-の酸塩基平衡の平衡定数は下記の通りである。
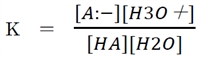
上のKにおいて、一般に水溶液では水の濃度は他よりも圧倒的に高いので、
[H2O](水の濃度)を55.6Mの一定値とし、K×[H2O]=Kaと定める。
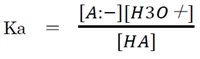
このKaをHAの酸解離定数と呼ぶ。酸解離定数(Ka)は一定条件下でそれぞれの物質が固有の値を示す。
ここで、H3O+をH+とすると次が成り立つ。

この式は弱酸性物質のヘンダーソン・ハッセルバルヒの式と呼ばれ、
溶液のpH,HAのpKa,分子形濃度[HA],イオン形濃度[A-]の関係式として重要である。
これを変形すると、
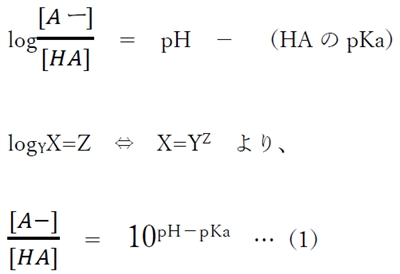
(1)式より、弱酸性物質のあるpHにおけるHA(分子形)とA-(陰イオン形)の存在割合(存在比)がわかる。
(1)式を用い、弱酸性物質のpH=pKa-2,pKa-1,pKa,pKa+1,pKa+2の時の分子形HAとイオン形A-の存在割合(存在比)を計算してみる。
・pH=pKa-2の時

・pH=pKa-1の時

・pH=pKaの時

・pH=pKa+1の時

・pH=pKa+2の時

以上より、弱酸性薬物におけるpHの変化に対する分子形とイオン形の存在比(分率)について、次のように考えられる。
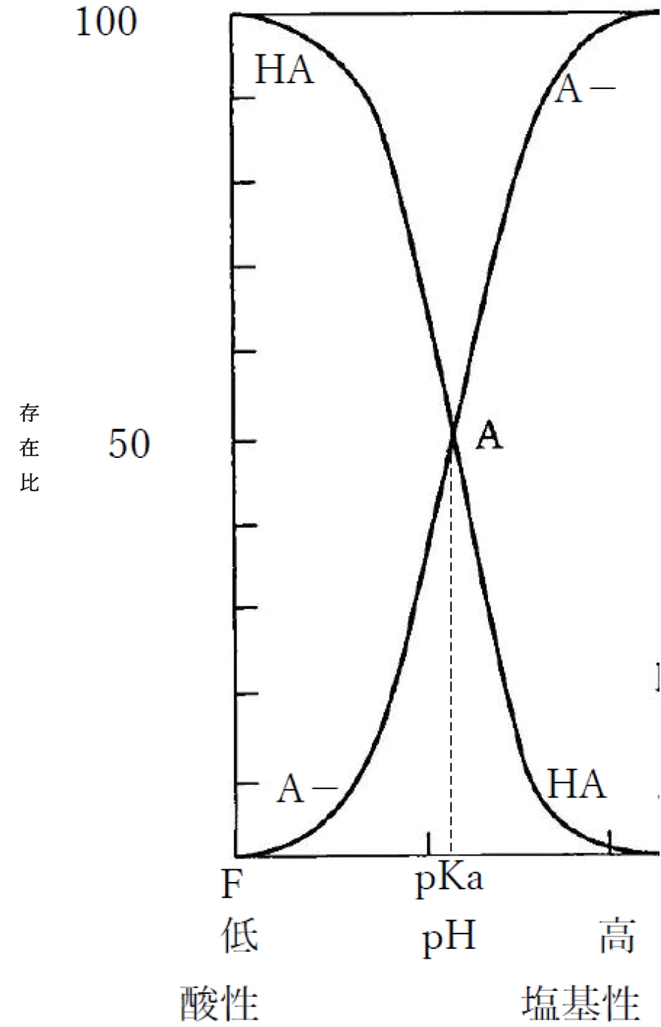
・弱酸性物質では、pHが上昇するのに伴い、分子形HAの存在割合(存在比)は低下し、陰イオン形A-の存在割合(存在比)は上昇する。
・弱酸性物質では、pHが低下するのに伴い、分子形HAの存在割合(存在比)は上昇し、陽イオン形A-の存在割合(存在比)は低下する。
・pHがpKaより2以上低い値の場合(pH≦pKa-2)、ほとんど分子形HAで存在している(分子形分率が99%以上)。
・pHがpKaと等しい場合(pH=pKa)、分子形HAとイオン形A-の存在比は1:1である(分子形とイオン形の分率が50%ずつ)。分子形とイオン形の濃度が等しい。
・pHがpKaより2以上高い値の場合(pH≧pKa+2)、ほとんどイオン形A-で存在している(イオン形分率が99%以上)。
下図は1価の弱酸性物質における溶液のpHと分子形(HA)および陰イオン形(A-)の存在比の関係を示す曲線である。
なお、弱塩基性物質におけるpHの変化に対する分子形・イオン形の分率・存在比の変化については、下記の別ページで解説しているので、併せて参照していただきたい。
弱塩基性物質におけるpHの変化に対する分子形・イオン形の存在比(分率)の変化 へ
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)