89回薬剤師国家試験問2 化学結合と混成軌道に関する記述
第89回薬剤師国家試験 問2
化学結合と混成軌道に関する下記の記述の正誤を判定してみよう。
a 基底状態の分子軌道では、反結合性軌道には電子が収容されない。
b 三フッ化ホウ素(BF3)のホウ素原子は、sp2混成軌道をもつ。
c 炭素−炭素二重結合の炭素間の結合距離は、単結合の場合より長くなる。
d アンモニアの窒素原子はsp2混成軌道をもち、分子全体はほぼ平面構造である。
第89回薬剤師国家試験 問2 解答解説
◆ aについて
a 〇 基底状態の分子軌道では、反結合性軌道には電子が収容されない。
原子が化学結合をしている際の電子の様子について、原子価軌道法と分子軌道法という2つの考え方がある。
原子価軌道法では、2つの原子においてそれぞれの価電子の電子軌道が重なり合うことにより共有結合が形成されていると考える。
一方、分子軌道法は分子において電子は特定の原子に属しているのではなく、電子は分子全体を動き回っていると考える。分子軌道法では、原子から分子が生成するときに、分子軌道という新たな分子における電子の軌道が出来るとし、その中を電子が動くと考える。
分子軌道が出来るときには、エネルギーの低い結合性軌道とエネルギーの高い反結合性軌道という2種の軌道が出来るのだが、一般に、分子が基底状態にあるときは、電子はエネルギーの低い結合性軌道に収容される。
◆ bについて
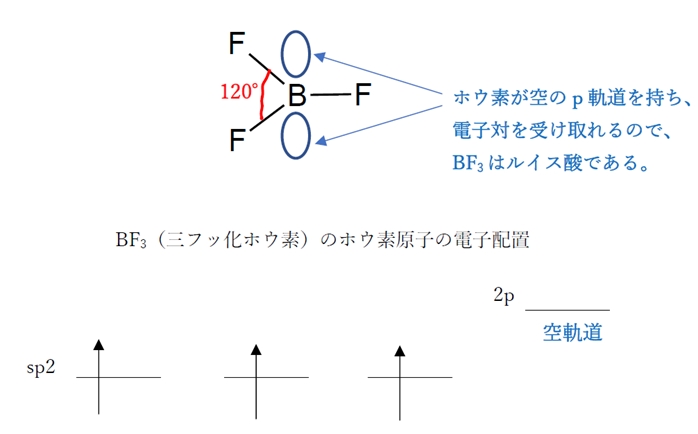
b 〇 三フッ化ホウ素(BF3)のホウ素原子は、sp2混成軌道をもつ。
三フッ化ホウ素(BF3)やボラン(BH3)のホウ素原子(B)は、sp2混成軌道をもち、かつ、空のp軌道を1つもっている。このB原子の空軌道で電子対を受け取ることができるので、三フッ化ホウ素(BF3)やボラン(BH3)はルイス酸である。
★参考外部サイトリンク
ルイス酸・塩基(薬学これでOK!さん)
女子高生と学ぶ!アミンのルイス塩基性とホウ素のルイス酸性&構造 (有機化学論文研究所)
◆ cについて
c × 炭素−炭素二重結合の炭素間の結合距離は、単結合の場合より長くなる。
→ 〇 炭素−炭素二重結合の炭素間の結合距離は、単結合の場合より短くなる。
★参考外部サイトリンク
共有結合によって結びついた物質(啓林館さん)
◆ dについて
d × アンモニアの窒素原子はsp2混成軌道をもち、分子全体はほぼ平面構造である。
→ 〇 アンモニアの窒素原子はsp3混成軌道をもち、分子全体はほぼ正四面体構造である。
★参考外部サイトリンク
混成軌道(猫でもわかる有機化学さん)