溶液の蒸気圧とモル分率・分子間相互作用 100回薬剤師国家試験問93
100回薬剤師国家試験 問93
次の文章の[ ① ][ ② ]に入る数値及び記号の正しい組合せはどれか。1つ選びなさい。
理想溶液がその気相と平衡にある場合、各成分の蒸気圧は溶液中のモル分率に比例する。成分XとYから成る液体を理想溶液とみなすとき、成分Xのモル分率0.5の溶液と平衡にある蒸気の成分Xのモル分率は[ ① ]となる。ただし、成分XとYの蒸気圧をそれぞれ500hPa、1000hPaとする。また、成分X、Yが理想溶液と
みなせず、XとYの分子間相互作用が同種分子間の相互作用よりも弱い場合の圧力は[ ② ]のようなグラフになる。
100回薬剤師国家試験 問93 解答解説
正解は7である。
◆ ①について
問題文に「理想溶液がその気相と平衡にある」とあることから、
本問では溶液の蒸気圧(蒸気全圧および各成分の蒸気分圧)と気体の圧力(全圧および各成分の分圧)は等しくなっている。
よって、溶液の蒸気圧を求めれば、気体の圧力が求まる。
次に、気体の分圧とモル分率は比例関係にあるので、
気体の圧力から各成分のモル分率を計算できる。
・溶液の各成分の蒸気圧を求める
ラウールの法則によると、理想溶液の成分iの蒸気分圧(P i)は、
成分iの純物質の蒸気圧(P i*)を比例定数とし、
iのモル分率(Xi)に比例する。
Pi = P i*・Xi
本問の溶液は成分XとYから成る理想溶液であり、
成分Xのモル分率は0.5であるので、成分Yのモル分率は0.5である。
また、成分XとYの純物質の時の蒸気圧はそれぞれ500hPa、1000hPaである。
これより、溶液の各成分の蒸気分圧(PX,PY)は下記のように計算される。
PX = P X*・XX
= 500hPa × 0.5 = 250hPa
PY = P Y*・XY
= 1000hPa × 0.5 = 500hPa
・気相中の成分Xのモル分率を求める
本問では理想溶液がその気相と平衡にあるので、
溶液の蒸気圧と気体の圧力は等しい。
よって、気相について、
気体Xの分圧は250hPa,気体Yの分圧は500hPaである。
気体の分圧とモル分率は比例関係にあるので、
気体の圧力から気相中の各成分のモル分率を次のように計算できる。

◆ ②について
活量aとは、実効濃度(または実効モル分率)である。
成分iの活量(ai)とモル分率(Xi)の間には下記の式が成り立つ。
ai = γ・Xi
γ:活量係数
活量係数γは理想溶液からのずれを表す係数である。
理想溶液では蒸気圧はラウールの法則に従い、
活量係数γは1である。
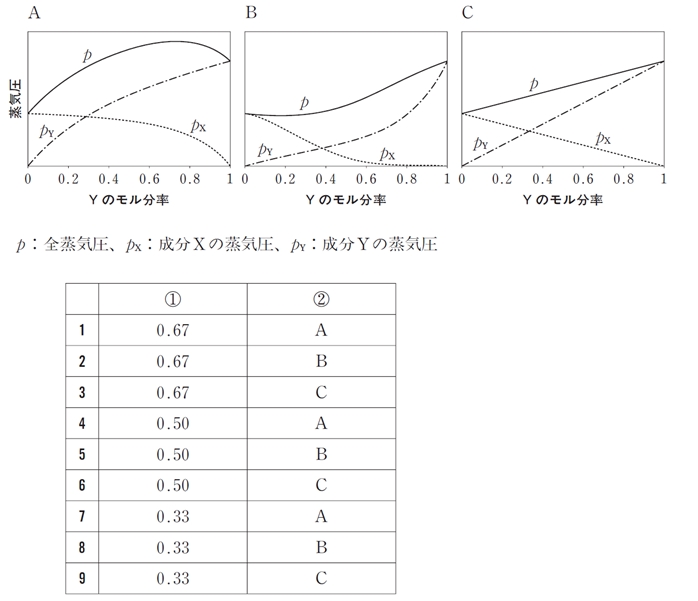
成分XとYからなる液体が理想溶液だった場合の蒸気圧を表すのは図Cである。

成分X、Yが理想溶液とみなせず、XとYの分子間相互作用が、XとXおよびYとYの同種分子間の相互作用よりも弱い場合の圧力は、
混合により蒸気圧は理想溶液のラウールの法則に従う場合よりも大きくなり、
正のずれを示し、
活量係数γは1よりも大きくなる(γ>1)。
これに該当するのはAの図である。

また、X-Yの異種分子間相互作用の方がX-XおよびY-Yの同種分子間相互作用よりも強い場合、
混合により蒸気圧は理想溶液のラウールの法則による蒸気圧よりも小さくなり、
負のずれを示し、
活量係数γは1よりも小さくなる(γ<1)。
これに該当するのはBの図である。

★ 他サイトさんの解説リンク
100回問93(e-RECさん)