蒸気圧と活量係数 87回薬剤師国家試験問21b
87回薬剤師国家試験 問21b
図に示されたアセトン−クロロホルム混合溶液の蒸気圧に関する記述の正誤を判定してみよう。
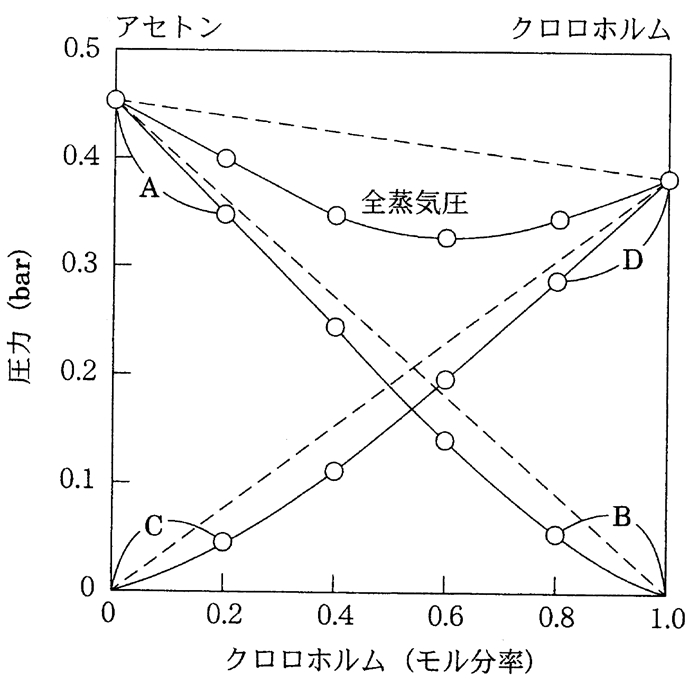
b アセトンとクロロホルム1:1混合溶液のアセトンの活量係数は1より小さい。
87回薬剤師国家試験問21b 解答解説

b 〇 アセトンとクロロホルム1:1混合溶液のアセトンの活量係数は1より小さい。
アセトンとクロロホルム1:1混合溶液の蒸気圧(実線)は、ラウールの法則による蒸気圧(点線)よりも小さいので、アセトンの活量係数は1より小さいと考えられる。
以下、詳細
活量aとは、実効濃度(または実効モル分率)である。
成分iの活量(ai)とモル分率(Xi)の間には下記の式が成り立つ。
ai = γ・Xi
γ:活量係数
活量係数γは理想溶液からのずれを表す係数である。
理想溶液ではX-Yの異種分子間相互作用とX-XおよびY-Yの同種分子間相互作用は等しいとされ、
蒸気圧はラウールの法則に従い、
活量係数γは1である。
下の図は成分XとYからなる液体が理想溶液だった場合の蒸気圧である。

X-Yの異種分子間相互作用の方がX-XおよびY-Yの同種分子間相互作用よりも強い場合、
混合により蒸気圧は理想溶液のラウールの法則による蒸気圧よりも小さくなり、
負のずれを示し、
活量係数γは1よりも小さくなる(γ<1)。
X-Yの異種分子間相互作用の方がX-XおよびY-Yの同種分子間相互作用よりも弱い場合、
混合により蒸気圧は理想溶液のラウールの法則による蒸気圧よりも大きくなり、
正のずれを示し。
活量係数γは1よりも大きくなる(γ>1)。