ラウールの法則とヘンリーの法則 アセトン−クロロホルム混合溶液の蒸気圧 87回薬剤師国家試験問21
87回薬剤師国家試験 問21
溶液の理想性又は非理想性は,その蒸気圧から判断できる。
図に示されたアセトン−クロロホルム混合溶液の蒸気圧に関する記述のうち,正しいものはどれか。
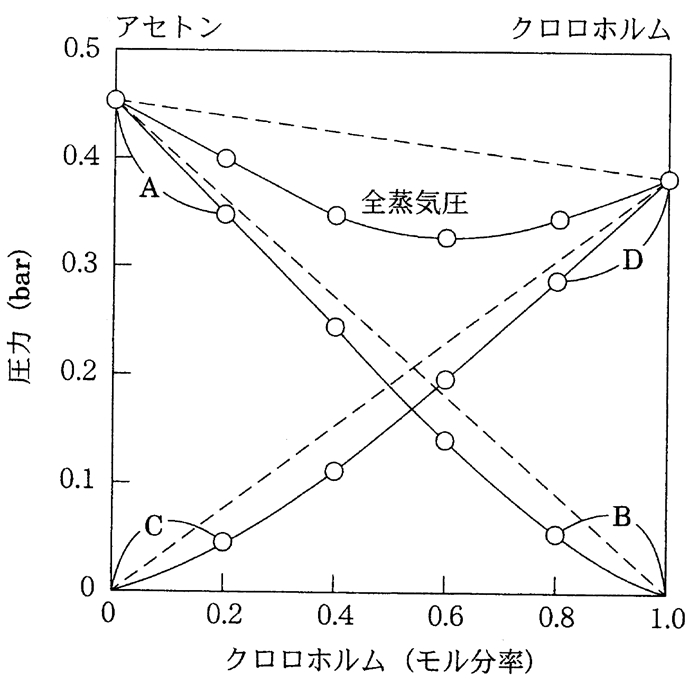
a アセトン−クロロホルム混合溶液は全組成において理想溶液である。
b アセトンとクロロホルム1:1混合溶液のアセトンの活量係数は1より小さい。
c 図のA,B,C,Dで示されたそれぞれの領域で,ラウール(Raoult)の法則が近似的に成り立っているのは,A,Dである。
d 図のA,B,C,Dで示されたそれぞれの領域で,ヘンリー(Henry)の法則が近似的に成り立っているのは,A,Dである。
87回薬剤師国家試験 問21 解答解説
◆ aについて
a × アセトン−クロロホルム混合溶液は全組成において理想溶液である。
理想溶液とは、ラウールの法則に従う溶液である。
ラウールの法則とは、気相と平衡にある理想溶液の成分iの蒸気分圧(P i)は、
成分iの純物質の蒸気圧(P i*)と成分iのモル分率(Xi)に等しいことであり、下記の式で表される。
Pi = P i*・Xi
ラウールの法則が成り立つ場合、成分iの蒸気分圧は、成分iの純物質の蒸気圧(P i*)を比例定数とし、iのモル分率(Xi)に比例するともいえる。

図のアセトン−クロロホルム混合溶液の蒸気圧について、
点線がラウールの法則に従う場合の蒸気圧を表しているが、
実際の挙動を示す実線は点線より大きく下方にずれている所があるので、
アセトン−クロロホルム混合溶液は全組成において理想溶液であるとはいえない。
◆ bについて
b 〇 アセトンとクロロホルム1:1混合溶液のアセトンの活量係数は1より小さい。
アセトンとクロロホルム1:1混合溶液の蒸気圧(実線)は、ラウールの法則による蒸気圧(点線)よりも小さいので、アセトンの活量係数は1より小さいと考えられる。
下記のリンク先を参照
蒸気圧と活量係数 87回問21b
◆ cについて
c 〇 図のA,B,C,Dで示されたそれぞれの領域で,ラウール(Raoult)の法則が近似的に成り立っているのは,A,Dである。
ラウールの法則が近似的に成り立つのは希薄溶液の溶媒の蒸気圧である。
その理由は、希薄溶液では、溶媒分子の周りはほとんど溶媒分子だらけで、溶媒分子にとっては純物質の時と状況は変わらないからである。
設問の図において、
希薄溶液の溶媒の蒸気圧に該当するのはAとDであり、
これらはラウールの法則が近似的に成り立つ。
の法則が近似的に成り立っているのは.jpg)
Aはアセトンを溶媒、クロロホルムを溶質とする希薄溶液のアセトンの蒸気圧である。
Dはクロロホルムを溶媒、アセトンを溶質とする希薄溶液のクロロホルムの蒸気圧である。
◆ dについて
d × 図のA,B,C,Dで示されたそれぞれの領域で,ヘンリー(Henry)の法則が近似的に成り立っているのは,A,Dである。
→ 〇 図のA,B,C,Dで示されたそれぞれの領域で,ヘンリー(Henry)の法則が近似的に成り立っているのは,B,Cである。
希薄溶液における溶質分子は溶媒分子に囲まれており、純物質の時と状況は異なる。
そのため、希薄溶液における溶質分子の蒸気圧は、ラウールの法則ではなく下記のヘンリーの法則が近似的に成り立つ。
Pi = Ki・Xi
Pi:成分iの蒸気圧 Xi:成分iのモル分率
ヘンリーの法則によると、
希薄溶液の溶質の蒸気圧はモル分率に比例するが、
その比例定数(Ki)は純物質の時の蒸気圧ではない。
設問の図において、
希薄溶液の溶質の蒸気圧に該当するのはBとCであり、
これらはヘンリーの法則が近似的に成り立つ。
の法則が近似的に成り立っているのは.jpg)
Bはクロロホルムを溶媒、アセトンを溶質とする希薄溶液のアセトンの蒸気圧である。
Cはアセトンを溶媒、クロロホルムを溶質とする希薄溶液のクロロホルムの蒸気圧である。