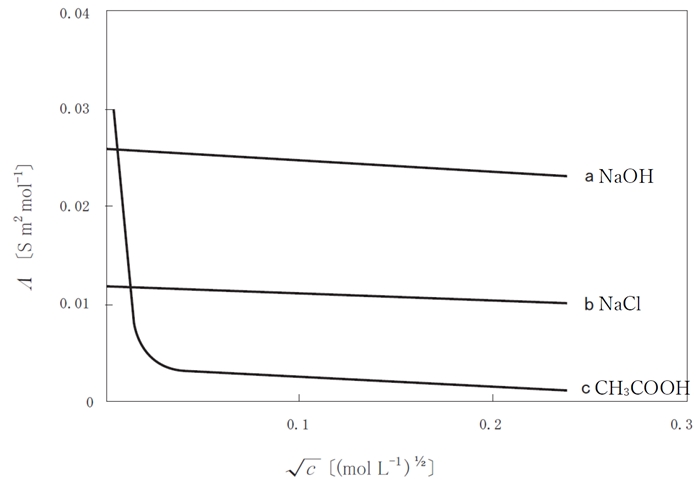
強電解質のモル伝導率と濃度の関係 96回薬剤師国家試験問20ab
96回薬剤師国家試験 問20ab
電解質溶液の電気伝導率(導電率)に関する記述の正誤を判定してみよう。ただし、モル伝導率をΛとする。
a 強電解質の希釈溶液では、Λは濃度に対して直線的に減少する。
b 強電解質の濃度が高くなるとΛが小さくなるのは、陽イオンと陰イオンの相互作用によってイオンの動きが抑えられるからである。
96回薬剤師国家試験 問20ab 解答解説
a × 強電解質の希釈溶液では、モル伝導率Λは濃度に対して直線的に減少する。
→ 〇 強電解質の希釈溶液では、モル伝導率Λは濃度の平方根に対して直線的に減少する。
b 〇 強電解質の濃度が高くなるとモル伝導率Λが小さくなるのは、陽イオンと陰イオンの相互作用によってイオンの動きが抑えられるからである。
電解質のモル伝導率(Λ)とは、1mol当たりの電気伝導率(κ)であり、次式で表される。
Λ = κ/c
c:モル濃度
コールラウシュによると、
強電解質の希薄溶液では、
モル伝導率(Λ)は濃度の平方根(√c)に対して直線的に減少し、
次式が成り立つ。
Λ = Λ0 − B√c
Λ0は極限モル伝導率と呼ばれ、
濃度が0に外挿された時の濃度モル伝導率(無限希釈のモル伝導率)である。
Bはイオンの種類などで決まる比例定数である。
電解質濃度の上昇に伴いモル伝導率が減少する理由として、
電解質の濃度が高くなるほど、
陽イオンと陰イオンの相互作用が強まり、
イオンの動きが抑えられることが挙げられる。
下の図のaがNaOH,bがNaClのモル伝導率を示すが、このように強電解質のモル伝導率(Λ)は濃度の平方根(√c)に対して直線的に減少する。