金属のイオン化傾向と酸化力・還元力および標準電極電位の関係
本ページでは、金属のイオン化傾向と酸化力・還元力および標準電極電位の関係について説明しています。
☆ 金属のイオン化傾向と酸化力・還元力の関係
金属のイオン化傾向とは、電子を失って陽イオンになる傾向のことである。
下記の金属(M)の酸化還元反応について、イオン化傾向と酸化力・還元力の関係について述べる。
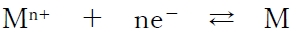
・金属(M)のイオン化傾向が大きいほど、左方向への反応が進みやすく、金属(M)は相手に電子を与える還元剤になりやすく還元力が強いといえる。
・金属(M)のイオン化傾向が小さいほど、右方向への反応が進みやすく、金属の陽イオンは(Mn+)は相手から電子を受け取る酸化剤になりやすく、酸化力が強いといえる。
☆ 金属のイオン化傾向と標準電極電位の関係
リチウム(Li)はイオン化傾向の大きい金属である。
(Li+|Li)電極の標準電極電位(25℃)は約−3Vである。
銀(Ag)はイオン化傾向の小さい金属である。
(Ag+|Ag)電極の標準電極電位(25℃)は約+0.8Vである。
このように、
金属(M)のイオン化傾向と、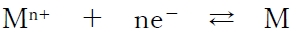
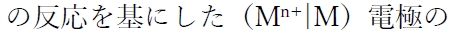
標準電極電位には下記の関係がある。
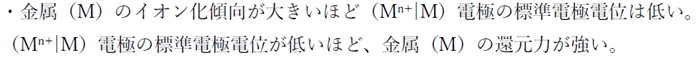
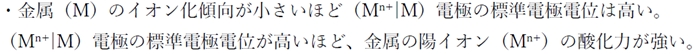
★ 参考外部サイトリンク
金属のイオン化傾向(技術情報館さん)