化学電池の放電とギブズエネルギー変化 100回薬剤師国家試験問95
第100回薬剤師国家試験 問95
NAD+及びCH3CHOの還元反応及び標準電位を以下に示した。

pH 7、25℃における、NAD+/NADH 及びCH3CHO/CH3CH2OH からなる化学電池が放電するときの標準ギブズエネルギー変化(kJ・mol-1)の値に最も近いのはどれか。1つ選びなさい。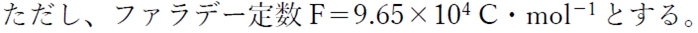
1 -49.9
2 -23.7
3 -11.9
4 11.9
5 23.7
第100回薬剤師国家試験 問95 解答解説
定温定圧下、化学電池の放電から取り出せるの有用な仕事の最大値(w)は、ギブズエネルギーの減少量(⊿G)に等しい。
このことから、
本問の化学電池が放電するときの標準ギブズエネルギー変化(⊿G゜)は、
電子の化学量論係数をn,標準起電力をE゜,ファラデー定数をFとすると、
次式で求められる。
⊿G゜ = -w
⊿G゜ = -(n・F・E゜)

本問の半電池の標準電位は、
CH3CHO/CH3CH2OHの方が
NAD+/NADHよりも高いため、
CH3CHO/CH3CH2OHが正極(カソード)、
NAD+/NADHが負極(アノード)となり、
全電池反応は
CH3CHO + NADH + H+
→ CH3CH2OH + NAD+
となる。
本問の化学電池では、電子の化学量論係数は2である。
標準起電力 = (正極の標準電位) - (負極の標準電位)
で求められる。
よって、この化学電池での標準起電力(E゜)は、
E゜= (-0.197V) - (-0.320V)
E゜= 0.123V
である。
したがって、
本問の化学電池が放電するときの標準ギブズエネルギー変化(⊿G゜)は、
下記のように求められる。
⊿G゜= -w
⊿G゜= -(n・F・E゜)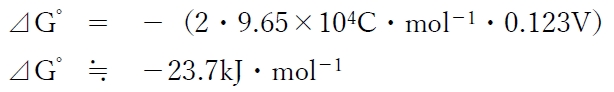
化学電のが放電のギブズエネルギー変化(⊿G)については、
下記のリンク先を参照
★他サイトさんの解説へのリンク
100回問95(e-RECさん)