89回薬剤師国家試験問20 ダニエル電池
89回薬剤師国家試験 問20
図は塩橋を用いたダニエル電池を示す。この電池の酸化還元平衡は次式で表せる。
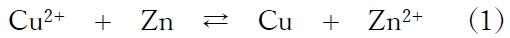
また、Zn電極、Cu電極の標準電極電位(25 ℃) E°はそれぞれ−0.763 V、+0.337 Vである。
次の記述の正誤を判定してみよう。

a 図の左側の電極では還元反応が、右側の電極では酸化反応が起こり、
全電池反応は(1)式となる。
b 電池の起電力は、左側の電極を基準とし、還元電位とも呼ばれる。
c 起電力は左側の半電池を基準とするので、ダニエル電池の標準起電力E°は+1.10 Vである。
d 塩橋を用いているので、電極電位以外に液間電位差を考慮する必要がある。
89回薬剤師国家試験 問20 解答解説
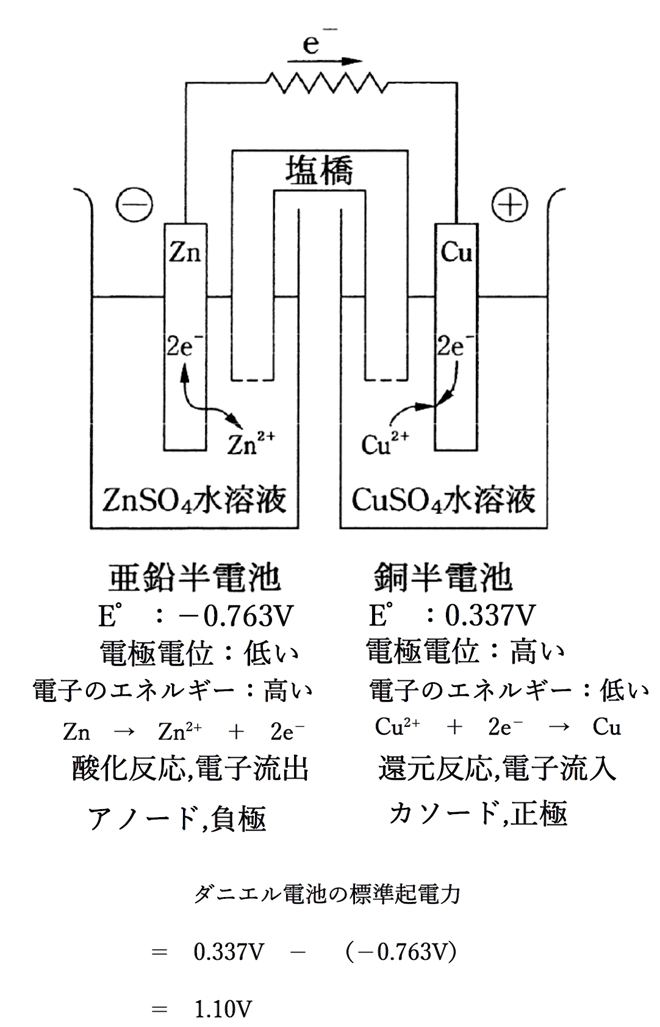
亜鉛半電池(Zn2+/Zn反応系)と銅半電池(Cu2+/Cu反応系)を導線でつないで作られるダニエル電池について、
各電極(半電池)の状態、および、標準起電力は下の図のようになると考えらえる。
● aについて
a × 図の左側の電極では還元反応が、右側の電極では酸化反応が起こり、
全電池反応は(1)式となる。
→ 〇 図の左側の電極では酸化反応が、右側の電極では還元反応が起こり、
全電池反応は(1)式となる。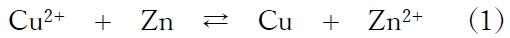
・左側:亜鉛半電池(Zn2+/Zn反応系)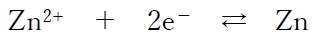
Zn2+/Zn反応系の標準電極電位(25℃)E゜は、−0.763 Vである。
・右側:銅半電池(Cu2+/Cu反応系)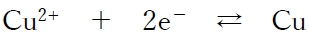
Zn2+/Zn反応系の標準電極電位(25℃)E゜は、+0.337 Vである。
電子のエネルギーと電位の関係について、
電位が低いほど電子のエネルギーは高く、
電位が高いほど電子のエネルギーは低い。
よって、自発的な変化では、
電子はエネルギーが低い方を求めて電位が低い方から高い方へと流れる。
そのため、
電極電位の低い電極では酸化反応が起こり、
電極電位の高い電極では還元反応が起こる。
E゜(Cu2+/Cu)>E゜(Zn2+/Zn)
より、
ダニエル電池では、
(Zn2+/Zn)から電子が流出し、(Cu2+/Cu)へと電子が流入する。
よって、ダニエル電池では、各電極で次のことが起こる。
電位の低い(Zn2+/Zn)は
電子が流出するので負極となり、
Zn → Zn2+ + 2e−
という酸化反応に反応が偏る。
電位の高い(Cu2+/Cu)は
電子が流入するので正極となり、
Cu2+ + 2e− → Cu
という還元反応に反応が偏る。
全電池反応は下記の反応に偏る。
Cu2+ + Zn → Cu + Zn2+
● bについて
b × 電池の起電力は、左側の電極を基準とし、還元電位とも呼ばれる。
→ 〇 電池の起電力は、左側の電極を基準とし、酸化電位とも呼ばれる。
電池とは電位差を作り出すことにより電子の流れと電流を生じさせるものを指し、
結果として、電池は電気エネルギー,電気的仕事を発生させる。
起電力とは電流の駆動力であり、
化学電池の起電力は両電極間の電位差(電圧)である。
電池の起電力は、酸化反応が起こる電極(負極,アノード)の電位を基準とし、
還元反応が起こる電極(正極,カソード)の電位との差で表される。
電池の起電力 = (正極の電位) − (負極の電位)
電池式(電池図)では、左側に負極,右側に正極が来るように書かれる。
下記はダニエル電池の電池式である。
(−) Zn / ZnSO4 aq | CuSO4 aq / Cu (+)
このことから、電池の起電力は、電池式における左側の電極(負極)を基準とし、
酸化電位とも呼ばれる。
● cについて
c 〇 起電力は左側の半電池を基準とするので、
ダニエル電池の標準起電力E°は+1.10 Vである。
電池の標準起電力は下記のように計算できる。
電池の標準起電力 = (正極の標準電極電位) − (負極の標準電極電位)
問題文より、
Zn電極とCu電極の標準電極電位(25 ℃) E°はそれぞれ−0.763 V、+0.337 Vであるので、
ダニエル電池の標準起電力E°は次のように計算できる。
ダニエル電池の標準起電力 = +0.337V − (−0.763V) = +1.10V
● dについて
d × 塩橋を用いているので、電極電位以外に液間電位差を考慮する必要がある。
→ 〇 塩橋を用いているので、液間電位差を考慮する必要はない。
塩橋には両極間の液間電位差を減少する働きがあるので、
これを設置することにより液間電位差を考慮する必要がなくなる。
酸化・還元については下記のリンク先を参照
酸化・還元とは
化学電池の成り立ちについては下記のリンク先を参照
化学電池の成り立ち