金属Mとそのイオンからなる半電池… 標準電極電位 102回薬剤師国家試験問92
第102回薬剤師国家試験 問92
第102回薬剤師国家試験 問92 解答解説
● 1について
1 × E°は、金(Au)の半電池を基準とした相対値として測定される。
→ 〇 標準電極電位(E°)は、水素の半電池を基準とした相対値として測定される。
詳細は下記のリンク先を参照
標準電極電位とは
● 2について
2 〇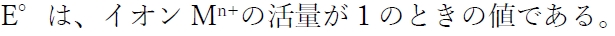
標準電極電位(標準酸化還元電位)は、電池内での酸化還元反応に関わる全ての化学種の活量が1という条件で算出された電極電位である。
● 3について
3 × E°は、負の値をとらない。
→ 〇 E°は、負の値をとることがある。
標準電極電位(標準酸化還元電位)は、
基準電極である標準水素電極の電極電位を0Vとし、
それに対する測定対象電極の電極電位の相対値で表される。
測定対象電極の電極電位が標準水素電極の電極電位よりも低ければ、
測定対象電極の標準電極電位は負の値で表される。
測定対象電極の電極電位が標準水素電極の電極電位よりも高ければ、
測定対象電極の標準電極電位は正の値で表される。
● 4について
4 × E°は、温度に依存せず一定である。
→ 〇 E°は、温度によって変化する。
酸化還元反応の反応性は温度によって変化するので、電極電位は温度によって変化する。
● 5について
5 〇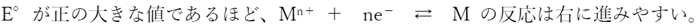
金属MとそのイオンM n+ の半電池において、
標準電極電位(E゜)が高いほど
M n+ + ne− → M
の反応(還元反応)が進みやすく、
標準電極電位(E゜)が低いほど
M → M n+ + ne−
の反応(酸化反応)が進みやすい。
以下、補足説明
☆ 標準電極電位(標準酸化還元電位)と酸化力・還元力の関係
電子のエネルギーは電位が低いほど高い。
自発的な変化はエネルギーが高い方から低い方へと進む。
よって、電子の自発的な流れでは、
電子は電位が低い方から高い方へと流れる。
このことから、
酸化還元反応系の電極電位と酸化体の酸化力、還元体の還元力の関係は下記の通り。
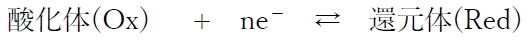
電極電位の高い酸化還元系では電子が流入して酸化体が還元される反応が起こりやすい。
よって、酸化還元反応系の標準電極電位(標準酸化還元電位)が高いほど、その酸化還元反応系は電子が流入して酸化体が還元されやすく、その酸化還元反応系の酸化体の酸化力は強いといえる。
したがって、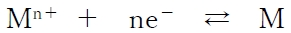
の酸化還元反応について、
E°が正の大きな値であるほど、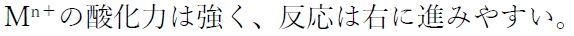
また、金属Mのイオン化傾向(陽イオンになりやすさの程度)が小さいほど、
E°は高いといえる。
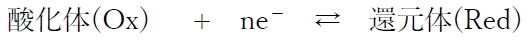
電極電位の低い酸化還元系では電子が流出して還元体が酸化される反応が起こりやすい。
よって、酸化還元反応系の標準電極電位(標準酸化還元電位)が低いほど、その酸化還元反応系は電子が流出して還元体が酸化されやすく、その酸化還元反応系の還元体の還元力は強いといえる。
したがって、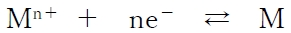
の酸化還元反応について、
E°が負の大きな値であるほど、
金属Mの還元力は強く、反応は左に進みやすい。
また、金属Mのイオン化傾向(陽イオンになりやすさの程度)が大きいほど、
E°は低いといえる。
★他サイトさんの解説へのリンク
102回問92(e-RECさん)