生体における膜電位の原理…濃淡電池 105回薬剤師国家試験問100
第105回薬剤師国家試験 問100
生体における膜電位の原理を理解するには、濃淡電池の作動原理を理解することが必要である。
電解質として用いる硫酸亜鉛の濃度のみが異なる2つの亜鉛半電池を塩橋でつないだ化学電池の模式図を以下に示す。
標準圧力下、298Kにおいて半電池Rの初濃度を0.1mol/L、半電池Lの硫酸亜鉛の初濃度をc1mol/Lとする。

なお、亜鉛半電池の反応は次式で表される(E゜は標準電位を表す)。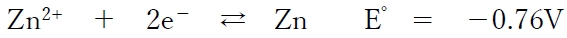
また、硫酸亜鉛は水中で完全に電離し、その活量は濃度に等しいとする。
この場合の亜鉛半電池の電極電位E(単位はV)は温度298Kでは次式で表される。
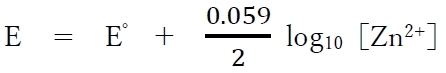
この半電池に関する下記の記述の正誤を判定してみよう。
1 この電池はダニエル電池である。
2 c1=0.01のとき、半電池Lがアノード(負極)となる。
3 この電池の標準起電力は0Vである。
4 半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態の起電力は−0.76Vである。
5 c1=0.01のとき、この電池の起電力は+0.059Vである。
第105回薬剤師国家試験 問100 解答解説
電気化学は酸化還元反応を熱力学的な観点から捉える。
化学電池を題材に電気化学の基礎を習得する。
● 1について
1 × この電池はダニエル電池である。
下記がダニエル電池である。
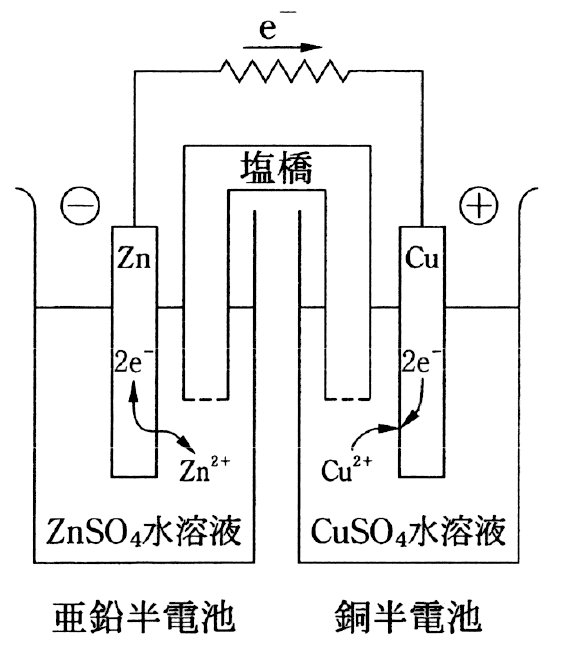
● 2について
2 〇 c1=0.01のとき、半電池Lがアノード(負極)となる。
濃淡電池では、
濃度が低い電極の方が電位が低く電子のエネルギーが高いので、電子が流出する酸化反応が起こる。よって、濃度が低い電極の方がアノード(負極)となる。
一方、濃度が高い電極の方が電位が高く電子のエネルギーが低いので、電子が流入する還元反応が起こる。よって、濃度が高い電極の方がカソード(正極)となる。
本問の濃淡電池において、
半電池Lの硫酸亜鉛の初濃度を0.01mol/L、
半電池Rの硫酸亜鉛の初濃度を0.1mol/Lとすると、
電池の状態は下記のようになる。
となる.jpg)

以下、補足説明
化学電池の成り立ちについては、
下記のリンク先を参照
化学電池の成り立ち
☆ 濃淡電池における電極電位と正極・負極の決定
濃淡電池とは、2つの電極(半電池)について、電極を構成する物質は同じだが、活量(濃度)が異なるために電極電位に差が生じている電池である。
本問の濃淡電池は、2つの半電池の間でZnSO4の濃度が異なり、Zn2+の活量が異なることで両極間に電位差が生じる。
上の図において、c1=0.01のとき、各半電池反応および全電池反応はどうなるか。
各半電池での電極電位を計算する。電極電位と活量の関係式としてネルンストの式があり、問の与式がそれに該当する。本来、ネルンストの式には活量が用いられるが、本問では活量≒濃度とし、Zn2+の濃度をZn2+の活量として扱える。
なお、本来のネルンスト式には固体のZnの活量も入っているが、固体の活量を1とするので、本問の与式はそれが予め省略された形になっている。
本問において、亜鉛半電池の電極電位(E)について、次が成り立つ。
なお、Eの単位はV(ボルト)である。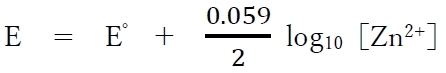
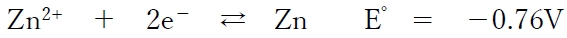
より、この酸化還元反応の標準酸化還元電位(E゜)は−0.76Vであるので、
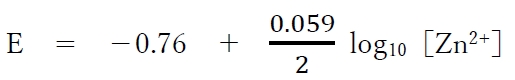
となる。
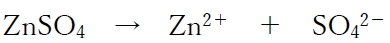
より、
各半電池のZn2+濃度は、
[Zn2+(L)]=0.01mol/L
[Zn2+(R)]=0.1mol/L
である。
よって、各半電池の電極電位は下記のように計算される。
・半電池Lの電極電位E(L)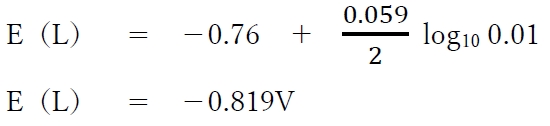
・半電池Rの電極電位E(R)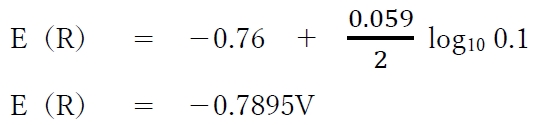
電子は電位が低い方から高い方へと流れるため、
E(L)< E(R)より、
本問の濃淡電池では、
半電池Lから電子が流出し、半電池Rへと電子が流入する。
したがって、
各半電池では次のことが起こる。
相対的に電位の低い半電池Lは負極(アノード)となり、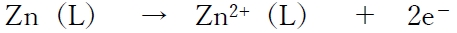
という酸化反応に反応が偏る。
相対的に電位の高い半電池Rは正極(カソード)となり、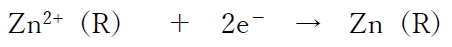
という還元反応に反応が偏る。
全電池反応は下記の通り。
本問の濃淡電池では、両半電池は隔絶されているので実際には両半電池間で物質の移動は起こらないが、
全電池反応が進むことにより、
見かけ上、Zn2+が濃度の高い電極から濃度の低い電極へと移動するような現象が起こる。

● 3について
3 〇 この電池の標準起電力は0Vである。
☆ 電池の起電力
電池とは、電位差を作り出すことにより、電子の流れと電流を生じさせるものを指し、
結果として、電池は電気エネルギー,電気的仕事を発生させる。
化学電池は、化学反応を利用し、電気エネルギーを取り出す装置である。
起電力とは、電流の駆動力であり、
化学電池の起電力は、両半電池間の電位差(電圧)である。
化学電池の起電力は、酸化反応が起こる半電池(負極,アノード)の電位を基準とし、
還元反応が起こる半電池(正極,カソード)の電位との差で表される。
電池の起電力 = (正極の電位) − (負極の電位)
標準起電力とは、各半電池の標準電極電位の差である。
標準起電力 = (正極の標準電位) − (負極の標準電位)
半電池の標準電極電位(標準酸化還元電位)とは、基準電極に標準水素電極を用い、気体水素の圧力が1atmで、電池内での酸化還元反応に関わる全ての化学種の活量が1という条件で算出された電極電位である。
濃淡電池では、2つの半電池について、電極を構成する物質は同じである。
よって、濃淡電池では、2つの半電池の標準電極電位は等しい。
濃淡電池では、
半電池Lの標準電極電位=半電池Rの標準電極電位
である。
したがって、濃淡電池の標準起電力は0Vである。
濃淡電池は両半電池を構成する物質は同じだが、両半電池間で物質の活量に差があることから電位の差が生まれ、電池として機能する。ここでの標準状態は電池内での酸化還元反応に関わる全ての化学種の活量が1というものであり、濃淡電池は標準状態では両半電池の物質の活量に差がないので電池として機能せず、起電力は0Vになる。
● 4について
4 × 半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態の起電力は−0.76Vである。
→ 〇 半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態の起電力は0Vである。
起電力とは電流の駆動力であり、化学電池の起電力は両電極間の電位差(電圧)である。
電池の起電力 = (正極の電位) − (負極の電位)
濃淡電池は両半電池を構成する物質は同じだが、両半電池間で物質の活量に差があることから電位の差が生まれ、電池として機能する。
本問では、硫酸亜鉛は水中で完全に電離し、その活量は濃度に等しい。
よって、Zn2+の活量=Zn2+の濃度
が成り立つ。
このことから、
半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態では、
両半電池でZn2+の活量が等しくなっている。
また、固体のZnの活量は1で一定である。
したがって、本問の濃淡電池において、
半電池Lと半電池Rの硫酸亜鉛濃度が等しくなった状態では、
半電池Lの電極電位=半電池Rの電極電位
となり、電池の起電力は0Vとなる。
酸化還元平衡で電極電位と電池の起電力については、
下記のリンク先を参照
酸化還元平衡での酸化還元電位と電池の起電力
● 5について
5 × c1=0.01のとき、この電池の起電力は+0.059Vである。
→ 〇 c1=0.01のとき、この電池の起電力は+0.030Vである。
問題文中の与式より、
c1=0.01のとき、各半電池の電極電位は下記のように計算される。
・半電池Lの電極電位E(L)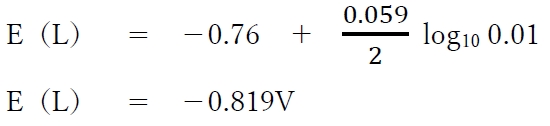
・半電池Rの電極電位E(R)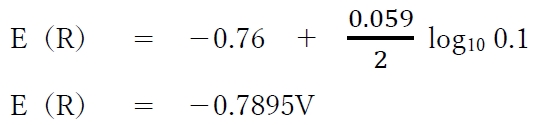
よって、c1=0.01のとき、
この電池の起電力は下記のように計算される。
電池の起電力 = (正極の電位) − (負極の電位)
電池の起電力 = (−0.7895V) − (−0.819V)
電池の起電力 = +0.030V
★他サイトさんの解説へのリンク
105回問100(e-RECさん)