酢酸と水酸化ナトリウムの混合液に関する記述 84回薬剤師国家試験問19
第84回薬剤師国家試験 問19
100 mLのメスフラスコに1.0 mol/L の酢酸水溶液10.0 mL 及び1.0 mol/L の水酸化ナトリウム水溶液5.0 mLを加えて、蒸留水で標線まで合わせた。酢酸の酸解離定数をKaとするとき、この混合液に関する次のa〜dの等式の正誤を判定してみよう。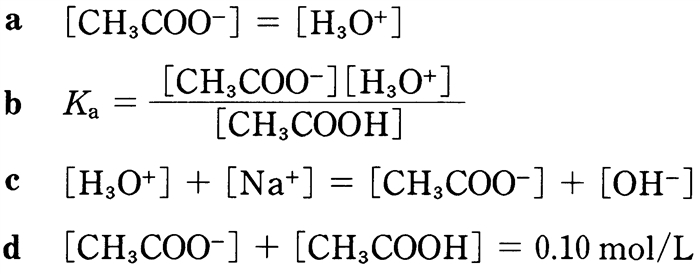
第84回薬剤師国家試験 問19 解答解説
1.0 mol/L の酢酸水溶液10.0 mL と1.0 mol/L の水酸化ナトリウム水溶液5.0 mLを加えると
次の反応が起こる。
CH3COOH + NaOH → CH3COONa + H2O
混合前後の各物質の量は下記の通り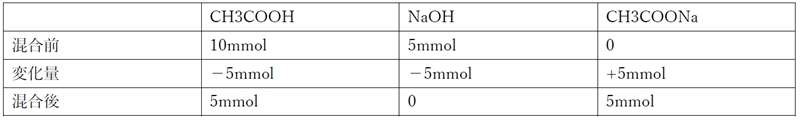
よって、混合後の溶液は、
CH3COOHとその共役塩基の塩であるCH3COONaからなる緩衝液である。
本問の混合溶液中の主な解離反応として、下記の(1)〜(4)が挙げられる。
.jpg)
CH3COOHは弱酸であり、割合としてほとんどが解離せずCH3COOHで存在していると考えられる。
(2) CH3COONa → CH3COO− + Na+
CH3COONaは強電解質であり、ほとんどがCH3COO−とNa+に電離していると考えられる。
.jpg)
本問の溶液ではCH3COONa の電離により多くのCH3COO−が生成する。
CH3COO−は塩基として働くがその塩基性は非常に弱く、割合としてほとんどがCH3COO−で存在していると考えられる。
.jpg)
水は自己解離するが、割合としてほとんどが解離せずH2Oのままで存在していると考えられる。
なお、水の自己解離を自己プロトリシスと呼ぶ。
以上のことを踏まえ、
a〜dの等式の正誤を考える。
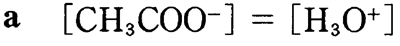
誤り
・CH3COO−の生成について
CH3COONaは水中でほとんど電離し、CH3COO−とNa+になっている。
5mmolのCH3COONaから5mmolのCH3COO−が生成していると考えられる。
・H3O+の生成について
混合後の溶液でH3O+が生成する反応として下記(1)(4)が挙げられる。
.jpg)
CH3COOHは弱酸であり、H+を解離するものはほんの一部である。
混合後の溶液にCH3COOHは5mmolあるが、CH3COOHの解離で生成するH3O+はわずかである。
.jpg)
水は自己解離するが、それはほんの一部である。
水が超大量にあるとしても、水の自己解離で生成するH3O+はわずかである。
以上のことから、
[CH3COO−]>[H3O+]
だと考えられる。
〇 本問の混合溶液の[H3O+]についての補足説明
酢酸は水中で次のように酸として働く。
これより、酢酸の酸解離定数Kaについて次式が成り立つ。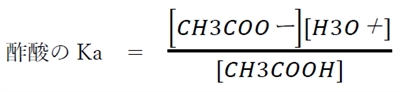
上式を変形すると、次式が成り立つ。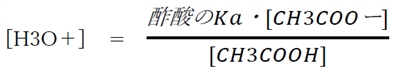
本問の混合溶液では、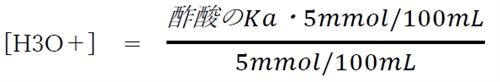
[H3O+] = 酢酸のKa
弱酸とその共役塩基の塩からなる緩衝液において、
弱酸の濃度とその共役塩基の濃度が等しい場合、
水素イオン濃度=弱酸のKa
pH=pka
が成り立つ。
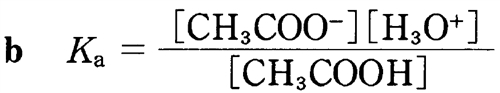
正しい
CH3COOHの酸解離定数Kaの定義式である。
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取ってHAになる。A:−を酸(HA)の共役塩基と呼ぶ。
上記の酸塩基平衡の平衡定数をHAの酸解離定数Kaまたは電離定数と呼び、
次式で表される。
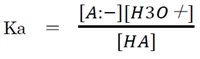
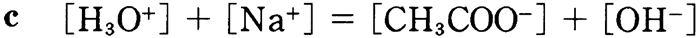
正しい
全ての溶液は電気的に中性であり、
溶液中では、正電荷の総和=溶液中の負電荷 が成り立っている。
これを電荷収支または電荷均衡則という。
本問の溶液に存在するイオンとして、
陽イオンはH3O+とNa+がほとんどであり、
陰イオンはCH3COO−とOH−がほとんどである。
したがって、本問の混合溶液では、電荷収支(電荷均衡則)より、
[H3O+]+[Na+]=[CH3COO−]+[OH−]
が成り立つとみなせる。
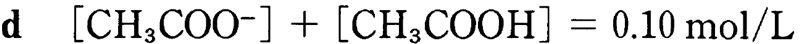
正しい
ある物質の物質量について、分子形とイオン形の全ての化学種をひっくるめた物質量を便宜的に全物質量という。
ある物質の物質量について、分子形とイオン形の全ての化学種をひっくるめた濃度を便宜的に全濃度という。
ある物質の全物質量はブレンステッド酸塩基反応(H+の放出・受け取り)の前後で等しい。
問題文より、はじめに1.0 mol/L の酢酸水溶液10.0 mLを採取している。
この酢酸水溶液中の酢酸の全物質量は、
1.0 mol/L ×10.0 mL=10mmolである。
これに水酸化ナトリウム溶液を加え、さらに蒸留水を加え、容量を100mLにしている。
一連の過程で、酢酸についてブレンステッド酸塩基反応しか起こっていないとすると、
混合後の溶液中の酢酸の全濃度は、
10mmol/100mL=100mmol/L=0.1mol/Lである。
本問の溶液中において、酢酸は混合前でも混合後でもCH3COOHかCH3COO−のいずれかの化学種で存在していると考えられるので、CH3COOHとCH3COO−を合わせた物質量を酢酸の全物質量とみなせ、CH3COOHとCH3COO−を合わせた濃度を酢酸の全濃度とみなせる。
したがって、混合後の溶液では、
[CH3COOH]+[CH3COO−]≒酢酸の全濃度=0.1mol/L
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)