酢酸と酢酸ナトリウムを容積比1:4で混合した水溶液のpH 86回薬剤師国家試験問19
第86回薬剤師国家試験 問19
0.05 mol/L酢酸水溶液と0.05 mol/L酢酸ナトリウム水溶液を容積比1:4の割合で混合したときに得られる水溶液のpHの値に最も近いものは次のどれか。
ただし、酢酸のpKa =4.5、またlog2 = 0.30、log3 = 0.48、log7 = 0.85とする。
1 3.0 2 4.0 3 5.0
4 6.0 5 7.0
第86回薬剤師国家試験 問19 解答解説
正解は3の5.0である。
酸塩基平衡のpHの計算では、計算の基となる酸または塩基を見つけることが重要である。
本問の水溶液は、酢酸(CH3COOH)とその共役塩基(CH3COO−)の塩である酢酸ナトリウム(CH3COONa)から成る緩衝液である。
弱酸とその共役塩基の塩の緩衝液のpHは、以下のように弱酸のヘンダーソン・ハッセルバルヒの式を用いて求められる。
弱酸のナトリウム塩であるCH3COONaは強電解質であり、水中ではほとんど電離している。
CH3COONa → CH3COO− + Na+
酸のヘンダーソン・ハッセルバルヒの式を用いてpHを算出する。
酸をHA,その共役塩基をA:−とすると、次式が成り立つ。

この式を混合溶液のCH3COOHとその共役塩基であるCH3COO−に適応する。
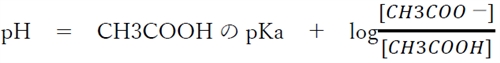
問題文より、「0.05 mol/L酢酸水溶液と0.05 mol/L酢酸ナトリウム水溶液を容積比1:4の割合で混合した」とあるので、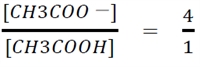
である。
よって、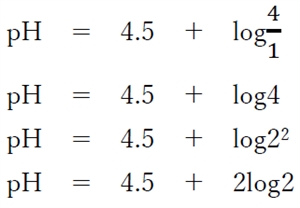
pH = 4.5 + 2・0.30
pH = 5.1
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)