リン酸と水酸化ナトリウムを混合した水溶液のpH 98回薬剤師国家試験問95
第98回薬剤師国家試験 問95
0.10mol/L リン酸400mL と0.20mol/L 水酸化ナトリウム300mLを混合した水溶液の25℃におけるpH に最も近いのはどれか。1つ選びなさい。
ただし、リン酸のpKa1= 2.12、pKa2= 7.21、pKa3= 12.32(各25℃)とする。
また、log 2= 0.30、log 3= 0.48とする。
1 4.7
2 6.9
3 7.2
4 7.7
5 9.8
第98回薬剤師国家試験 問95 解答解説
正解は3の7.2である。
リン酸(H3PO4)は酸として下記に示す通り三段階で解離する。

第一段階解離平衡,第二段階解離平衡,第三段階解離平衡の酸解離平衡定数をそれぞれKa1,Ka2,Ka3とする。
0.10mol/L リン酸400mL と0.20mol/L 水酸化ナトリウム300mLを混合すると、
最初は次の①の反応が進む。
H3PO4 + NaOH → NaH2PO4 + H2O …①
①の反応だけ進んだ後の各化学種の物質量は下記の通り。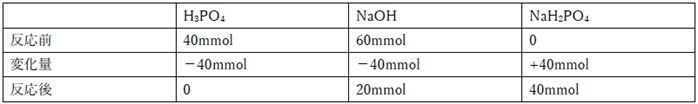
次に①の反応で生成したNaH2PO4と残りのNaOHが反応して、下記の②の反応が進む。
NaH2PO4 + NaOH → Na2HPO4 + H2O …②
②の反応が進んだ後の各化学種の物質量は下記の通り。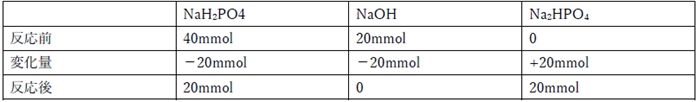
NaH2PO4は次のように電離する。
NaH2PO4は水中では完全に電離するが、
H2PO4-は水中ではほとんで電離しない。
Na2HPO4は次のように電離する。
Na2HPO4は水中では完全に電離するが、
HPO4 2-は水中ではほとんで電離しない。
よって、混合後の水溶液の各化学種の濃度は、
H2PO4-=20mmol/700mL,
HPO4 2-=20mmol/700mLであると考えられる。
以上より、混合後の水溶液について、
下記のリン酸の第二解離平衡に基づき、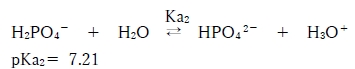
H2PO4-を酸、その共役塩基をHPO4 2-として、
次のヘンダーソン・ハッセルバルヒの式よりpHを求められる。

なお、本問の混合後の溶液は、
弱酸(H2PO4-)とその共役塩基の塩(Na2HPO4)の混合溶液である。
このような混合溶液は緩衝液となり、少量の酸や塩基が加えられることや希釈することに対してpHの変動を少なくするという緩衝作用を持つ。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)
★他サイトさんの解説へのリンク
98回問95(e-RECさん)