弱酸水溶液のpHと水酸化ナトリウムを混合後のpH 89回薬剤師国家試験問19
第89回薬剤師国家試験 問19
次の記述の〔a〕,〔b〕に入れるべき数値の正しい組合せはどれか。
ある弱酸(Ka = 8.0×10−5)の0.20 mol/L水溶液のpHは〔 a 〕であり、この水溶液と0.20 mol/L水酸化ナトリウム水溶液を2:1の割合で混合したときに得られるpHは〔 b 〕となる。
ただし、log 2 = 0.30、log 4 = 0.60、log 8 = 0.90とする。
a b
1 1.7 3.9
2 1.7 5.4
3 2.4 4.1
4 2.4 5.1
5 3.1 4.7
第89回薬剤師国家試験 問19 解答解説
正解は3のa2.4 b4.1 である。
◆aについて
酸塩基平衡のpHの計算では、計算の基となる酸または塩基を見つけることが重要である。
本問のaの算出では、ある弱酸(Ka = 8.0×10−5)が計算の基となる。
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取ってHAになる。A:−を酸(HA)の共役塩基と呼ぶ。
上記の酸塩基平衡の平衡定数をHAの酸解離定数Kaまたは電離定数と呼び、
次式で表される。
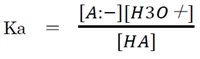
上記の酸解離定数(Ka)の式を改変することにより、
ある弱酸HAの水溶液の水素イオン濃度について、次式が成り立つ。
なお、Cをその弱酸HAの濃度とする。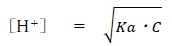
この式は重要なので必ず覚える。
この式を本問の弱酸HAに適応して水素イオン濃度を求める。

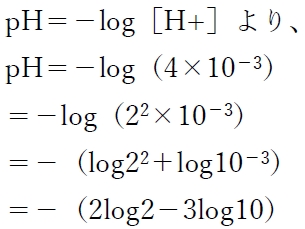
=−(2・0.30 − 3)
=−(0.6−3)
=2.4
◆bについて
ある弱酸HA(Ka = 8.0×10−5)の0.20 mol/L水溶液と0.20 mol/L水酸化ナトリウム水溶液を2:1の割合で混合した溶液のpHを求める。
酸塩基平衡のpHの計算では、計算の基となる酸または塩基を見つけることが重要である。
混合により、次の化学反応が起こる。
HA + NaOH → NaA + H2O
混合の前後で各化学種がどれだけあるかを考える。
便宜的にHAの水溶液2mLとNaOHの水溶液1mLを混合したと仮定する。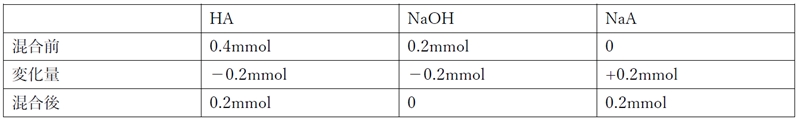
弱酸とその共役塩基の塩の混合溶液、または、弱塩基とその共役酸の塩の混合溶液は緩衝液である。
本問の混合後の水溶液は、弱酸HAとその共役塩基A−の塩(NaA)から成る緩衝液である。
弱酸とその共役塩基の塩の緩衝液のpHは、以下のように弱酸のヘンダーソン・ハッセルバルヒの式を用いて求められる。
一般に、弱酸のナトリウム塩は水中でほとんど電離していると考えられるので、
NaAは次のようにほとんど電離していると考えられる。
NaA → A:− + Na+
混合後の溶液では、弱酸HAとその共役塩基のA:−がpH計算の基となる。
ここで、酸のヘンダーソン・ハッセルバルヒの式を用いてpHを算出する。
酸をHA,その共役塩基をA:−とすると、次式が成り立つ。

この式を混合後の溶液のHAとその共役塩基であるA:−に適応する。
よって、混合後の溶液のpHを酸のヘンダーソン・ハッセルバルヒの式を用いて次のように計算できる。
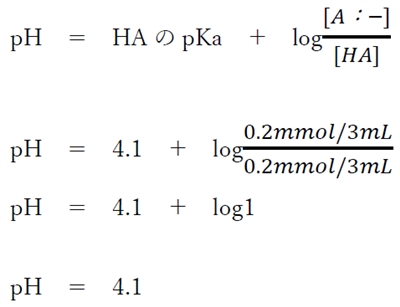
酸のヘンダーソン・ハッセルバルヒの式より、
酸とその共役塩基の存在比が1:1の時は、
pH=酸のpKa
が成り立つ。
なお、本問における混合後の溶液のように、弱酸とその共役塩基の塩が混在する溶液,または弱塩基とその共役酸の塩が混在する溶液を緩衝液といい、少量の酸や塩基が加えられることや希釈することに対してpHの変動を少なくするという緩衝作用を持つ。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)
pHの計算(弱酸・弱塩基溶液)(役に立つ薬の情報〜専門薬学さん)