0.10mol/L酢酸ナトリウム水溶液のpH 94回薬剤師国家試験問17
第94回薬剤師国家試験 問17
0.10mol/L酢酸ナトリウム水溶液のpHは次のどれか。
log2 = 0.30、log3 = 0.48とする。
1 7.3
2 7.8
3 8.3
4 8.8
5 9.3
6 9.8
第94回薬剤師国家試験 問17 解答解説
正解は4の8.8である。
本問は、弱酸と強塩基の塩の溶液のpHの計算である。
弱酸のナトリウム塩であるCH3COONaは強電解質であり、水中ではほとんど電離している。
CH3COONa → CH3COO- + Na+
そして、酢酸イオンCH3COO-は、
下記に示すように水中で弱い塩基として働く。
よって、本問では、
弱塩基であるCH3COO-の水溶液としてpHを計算すれば良い。
弱塩基の水溶液の水酸化物イオン濃度について、次式が成り立つ。
なお、Kbを弱塩基の塩基解離定数とし,Cを弱塩基の濃度とする。
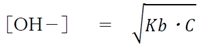
この式は重要なので必ず覚える。
この式を本問のCH3COO-に適応する。
まず、CH3COO-の塩基解離定数Kbを求める。
塩基のKbとその共役酸のKaと水のイオン積Kwについて、次式が成り立つ。
Ka × Kb = Kw …①
CH3COO-を塩基とすると、
その共役酸はCH3COOHであるので、次式が成り立つ。
(CH3COOHのKa) × (CH3COO-のKb) = Kw …②

次に、CH3COO-の濃度を求める。
CH3COONaは水中で次のように電離する。
CH3COONaは水中で完全電離するが、
CH3COO-は水中でほとんど電離しない。
よって、0.10mol/L酢酸ナトリウム水溶液のCH3COO-の濃度は0.10 mol/Lと考えられる。
以上より、本問の水溶液の水酸化物イオン濃度は次のように計算できる。
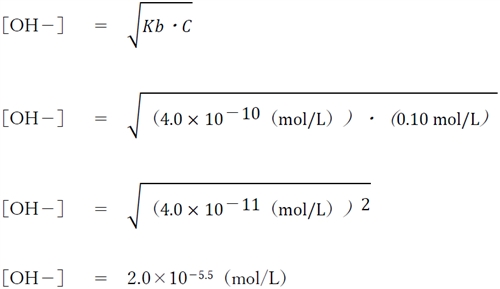
一定条件下において、
水素イオン濃度と水酸化物イオン濃度と水のイオン積Kwについて次式が成り立つ。
[H+]×[OH-] = Kw …③

★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)