大気と平衡にある水のpHと酸性雨 88回薬剤師国家試験問20
第88回薬剤師国家試験 問20
次の文章の[ ]内に入る語句の正しい組合せはどれか。
大気中に存在する二酸化イオウSO2と[ a ]が水に吸収されると、それぞれ最終的には[ b ]とHNO3に変化し、水のpHが[ c ]酸性雨となり、環境や生態系に悪影響を与える可能性がある。
一般に、pH=5.6以下の雨を酸性雨とよんでいる。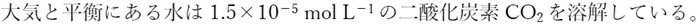
反応は次のように表される。
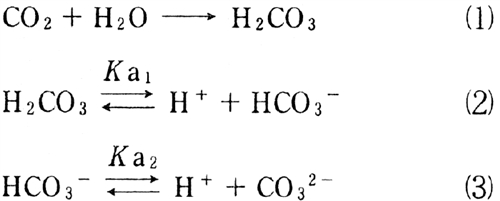
式(2)のpKa1=6.46、及び(3)のpKa2= 10.25である。
水溶液は酸性であるため、式(3)と水自身の解離によるプロトンの影響を無視できるとすると、弱酸の溶液のpHを求める次式を用いて水溶液のpHが求められる。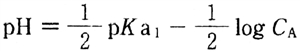
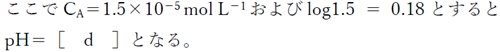
a b c d
1 リン酸 H2SO4 上がり 0.82
2 窒素酸化物 H2S 上がり 5.64
3 リン酸 H2SO4 下がり 6.64
4 窒素酸化物 H2SO4 下がり 5.64
5 窒素酸化物 H2SO3 下がり 0.82
第88回薬剤師国家試験 問20 解答解説
正解は4である。
大気中に存在する二酸化イオウSO2と[a 窒素酸化物]が水に吸収されると、
それぞれ最終的には[b H2SO4]とHNO3に変化し、水のpHが[c 下がり]酸性雨となり、環境や生態系に悪影響を与える可能性がある。
一般に、pH=5.6以下の雨を酸性雨とよんでいる。
◆ dについて
多塩基酸であるH2CO3の溶液のpHの計算である。
本問では、本文中の指示通り与式に与えられた値を代入するだけである。
H2CO3は二段階で解離してH+を放出する。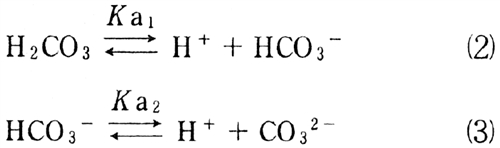
式(2)のpKa1=6.46、及び(3)のpKa2= 10.25である。
(2)の酸解離平衡のpka(pka1)と(3)の酸解離平衡のpka(pka2)を比べるとpka1の方が圧倒的に小さい。
pKa=−logKaより、Ka1はKa2より100倍以上の大きい値である。
よって、(2)の酸解離で放出されるH+の量は(3)の酸解離で放出されるH+の量よりも圧倒的に多いといえる。以上より、H2CO3の溶液のpHの計算において(3)の解離によるプロトンの影響を無視できる。
大気と平衡にある水はH2CO3の溶液であり、そのpHについて次式が成り立つ。
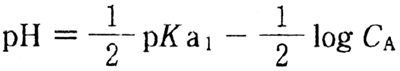
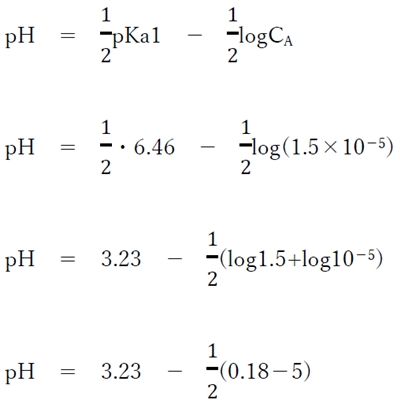
pH = 5.64
大気と平衡になっている水に硫黄酸化物と窒素酸化物が溶けて最終的に硫酸,硝酸が生成するとpHが5.6以下となる。これを酸性雨という。
〇 多塩基酸の溶液のpHの計算について
炭酸(H2CO3)やリン酸(H3PO4)のように複数の段階で解離する酸を多塩基酸という。
一般に、多塩基酸の酸解離平衡について、第一段階の酸解離平衡の酸解離定数(Ka1)と第二段階以降の解離平衡の酸解離定数を比較すると、第一段階の酸解離定数(Ka1)は他の段階の酸解離定数より100倍以上の大きい値であることが多い。
このことから、多塩基酸の酸解離について、第一段階で放出されるH+の量に比べて第二段階以降で放出されるH+の量は相対的に非常に少ないといえる。
よって、多塩基酸の溶液のpHの計算において、第一段階の酸解離定数(Ka1)が他の段階の酸解離定数より100倍以上の大きい値である場合は、第二段階以降の酸解離を無視し、第一段階の酸解離のみに着目してpHの計算を行って差し支えないことが多い。
〇 弱酸溶液のpHを求める次式について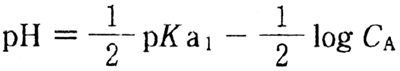
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取ってHAになる。A:−を酸(HA)の共役塩基と呼ぶ。
上記の酸塩基平衡の平衡定数をHAの酸解離定数Kaまたは電離定数と呼び、
次式で表される。
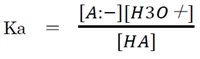
上記の酸解離定数(Ka)の式を改変することにより、
ある弱酸HAの水溶液の水素イオン濃度について、次式が成り立つ。
なお、Cをその弱酸HAの濃度とする。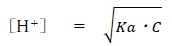
この式は重要なので必ず覚える。
上式の両辺の負の常用対数(−log)をとると次式になる。
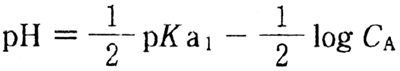
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)