酢酸と水酸化ナトリウムの混合溶液に塩酸を加えた溶液のpH 104回薬剤師国家試験問91
第104回薬剤師国家試験 問91
0.200mol/L 酢酸50.0 mL に0.100 mol/L 水酸化ナトリウム水溶液50.0mLを加えた。その後、この混合溶液に対して1.00mol/L 塩酸を1.00 mL加えた溶液のpHに最も近い値はどれか。1つ選びなさい。
ただし、酢酸のpKa= 4.70、log2=0.301、log3 = 0.477 とする。
1 2.01
2 3.41
3 4.52
4 4.70
5 4.93
104回薬剤師国家試験 問91 解答解説
正解は3の4.52である。
2回混合を行っているが、
混合の前後で各化学種がどれだけ存在するかを考える。
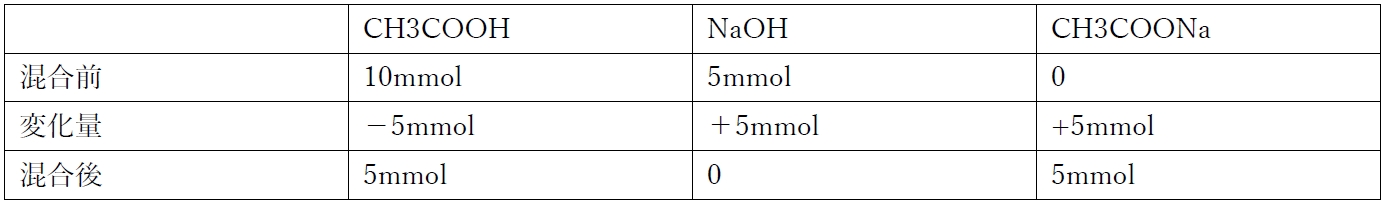
① 0.200mol/L 酢酸50.0 mL に0.100 mol/L 水酸化ナトリウム水溶液50.0mLを加えた。
①の混合により、次の反応が起こる。
CH3COOH + NaOH → CH3COONa + H2O
①の混合前後の各化学種の物質量は下記の通り。
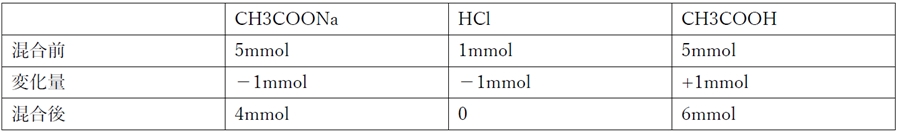
② その後、この混合溶液に対して1.00mol/L 塩酸を1.00 mL加えた。
②の混合により、次の反応が起こる。
CH3COONa + HCl → CH3COOH + NaCl
②の混合前後の各化学種の物質量は下記の通り。
②の混合後、
CH3COOHが6mmol/101mL,CH3COONaが4mmol/101mLの濃度で存在していると考えられる。
混合後の水溶液は、
弱酸(CH3COOH)とその共役塩基の塩(CH3COONa)から成る緩衝液である。
水溶液中でのCH3COOHとCH3COONaの電離は下記の通り。

CH3COONaは水中で完全に電離するが、
CH3COOHは水中ではほとんど電離しない。
弱酸とその共役塩基の塩の緩衝液のpHについて、
次の弱酸のヘンダーソン・ハッセルバルヒの式が成り立つ。

この式を②の混合後のCH3COOHとその共役塩基であるCH3COO-に適応する。
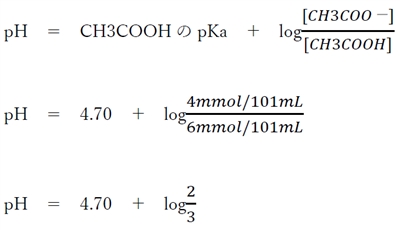
pH = 4.70 + log2 - log3
pH = 4.70 + 0.301 - 0.477
pH = 4.524
本問における混合後の溶液のように、弱酸とその共役塩基の塩が混在する溶液,または弱塩基とその共役酸の塩が混在する溶液を緩衝液といい、少量の酸や塩基が加えられることや希釈することに対してpHの変動を少なくするという緩衝作用を持つ。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)
★他サイトさんの解説へのリンク
104回問91(e-RECさん)