弱塩基B水溶液のpHと水の自己解離の影響 92回薬剤師国家試験問19
第92回薬剤師国家試験 問19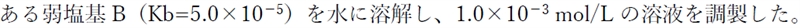
この溶液のpHに関する文章の[ ]の中に入れるべき数値と字句の正しい組合せはどれか。
弱塩基Bの水溶液中での解離は式(1)、水の自己解離は式(2)で表される。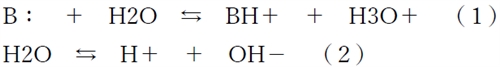
水の自己解離を無視すればこの溶液のpHは約[ a ]となる。
しかし、この溶液のような希薄溶液では、水の自己解離を無視できないため、この溶液のpHは水の自己解離を無視した場合よりも、[ b ]い値となる。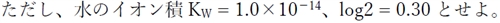
a b
1 9 高
2 10 高
3 11 高
4 9 低
5 10 低
6 11 低
92回薬剤師国家試験 問19 解答解説
正解は5のa.10 b.低 である。
◆ aについて
酸塩基平衡のpHの計算では、計算の基となる酸または塩基を見つけることが重要である。
本問の溶液は、ある弱塩基Bが計算の基となる。
塩基となる物質(B:)は非共有電子対を供与してプロトン(H+)を受け取って陽イオン形(BH+)となり、BH+はプロトンを放出してB:に戻る。BH+を塩基(B:)の共役酸と呼ぶ。
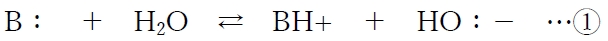
上記の酸塩基平衡の平衡定数をB:の塩基解離定数Kbと呼び、
次式で表される。
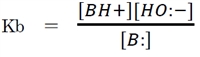
上記の塩基解離定数(Kb)の式を改変することにより、
弱塩基Bの水溶液の水酸化物イオン濃度について次式が成り立つ。
なお、Cをその弱塩基Bの濃度とする。
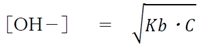
この式は重要なので必ず覚える。
問題文より、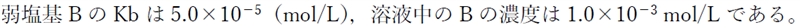
よって、本問の水溶液の水酸化物イオン濃度は次のように計算できる。
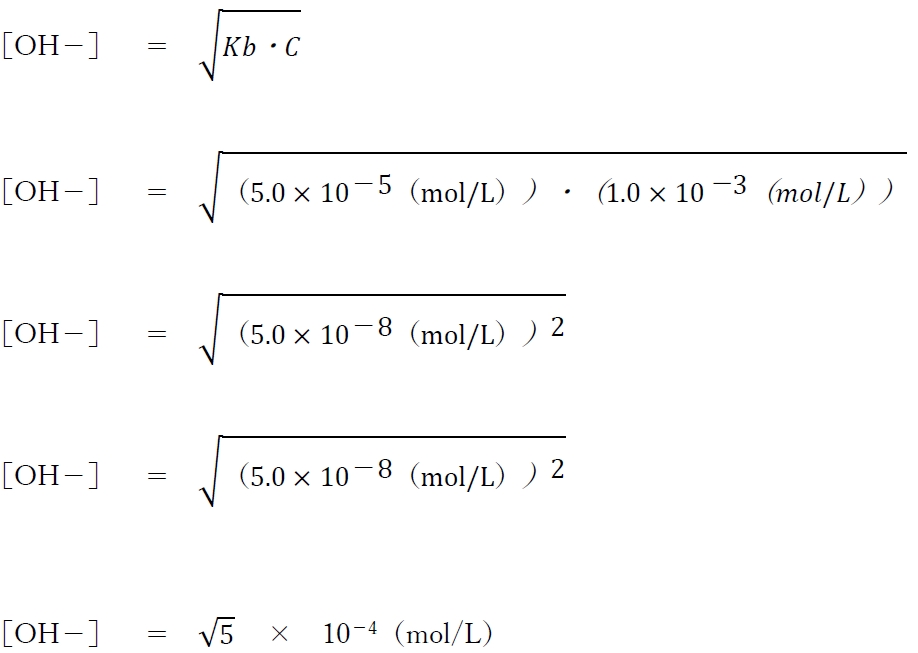
一定条件下において、水素イオン濃度と水酸化物イオン濃度と水のイオン積Kwについて次式が成り立つ。
[H+]×[OH−] = Kw
また、
pH=−log[H+],pOH=−log[OH−],
pKw=−logKw より、次式が成り立つ。
pH+pOH = pKw
本問の水溶液では、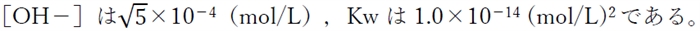
よって、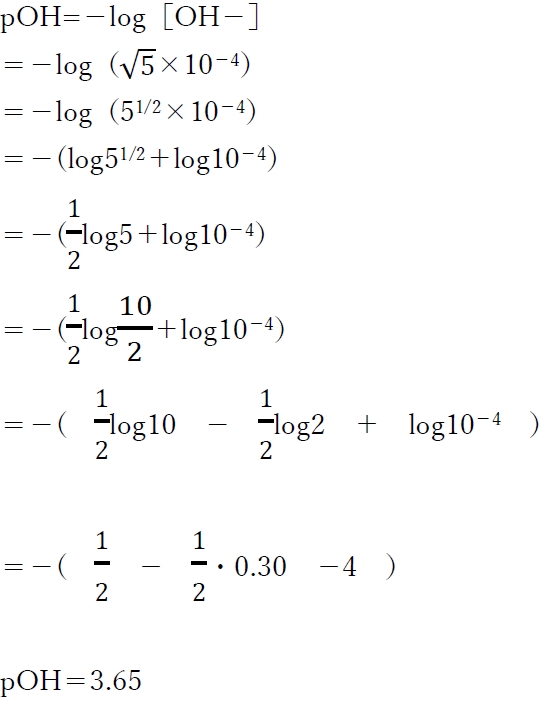
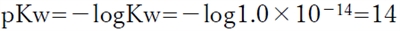
[H+]×[OH−] = Kw
pH+pOH=pKw より、
pH=pkw−pOH=14−3.65=10.35
◆ bについて
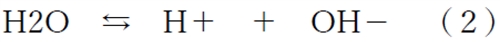
(2)で表されるように、水はわずかに解離している。これを水の自己プロトリシスという。
溶液中のH+およびOH−の濃度について、酸または塩基の希薄溶液では水の自己プロトリシスにより生成されるH+またはOH−の量を無視できず、酸性溶液(H+濃度が高い)ならばH+が減る方向に向かい、塩基性溶液(H+濃度が低い)ならばH+が増える方向に向かい、pHは単純な計算値から中性(pH7前後)方向に少し寄っていると考えられる。
問の弱塩基の希薄溶液のpHは水の自己プロトリシスを無視した計算値で10.35であったが、水の自己プロトリシスを考慮に入れると、塩基性溶液(H+濃度が低い)なのでH+が増える方向に向かい、実際のpHは10.35より低い値であると考えられる(水の自己プロトリシスでpHは7の方へ戻される)。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)