リン酸二水素一ナトリウムを水酸化ナトリウムで中和滴定 105回薬剤師国家試験問96
105回薬剤師国家試験 問96
0.100 mol/L リン酸二水素一ナトリウム水溶液10.00mLを0.100 mol/L 水酸化ナトリウム水溶液で中和滴定する。この滴定に関する記述の正誤を判定してみよう。ただし、リン酸は三塩基酸で、pKa1= 2.12、pKa2=7.21、
pKa3 =12.32であり、log2=0.301、log3 =0.477とする。
1 10.00mLを正確に量るために、メスピペットが用いられる。
2 滴定前のリン酸二水素一ナトリウム水溶液のpHは約1.6である。
3 水酸化ナトリウム水溶液を9.00mL加えたとき、滴定溶液のpHは約8.2である。
4 水酸化ナトリウム水溶液を10.00mL加えたとき、滴定溶液のpHは約9.8である。
5 この滴定の終点(10.00 mL 付近)の検出には、pH指示薬としてメチルオレンジが適している。
第105回薬剤師国家試験 問96 解答解説
◆ 1について
1 × 10.00mLを正確に量るために、メスピペットが用いられる。
→ 〇 10.00mLを正確に量るために、全量ピペット(ホールピペット)が用いられる。
詳細は下記のリンク先を参照
正確に量り取るための器具 105回問96の1
◆ 2について
2 × 滴定前のリン酸二水素一ナトリウム水溶液のpHは約1.6である。
リン酸二水素一ナトリウム(NaH2PO4)、リン酸一水素二ナトリウム(Na2HPO4)、
炭酸水素ナトリウム(NaHCO3)などH+を含む酸性塩は、水中で水に対して酸にも塩基にもなる。よって、これらを両性電解質と呼ぶ。
まず、リン酸二水素一ナトリウム(NaH2PO4)は、水中ではほとんどがH2PO4-とNa+に解離する。
そして、H2PO4-は下記のように水中で酸または塩基となる。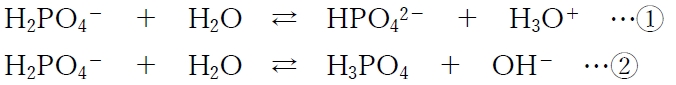
①と②の反応が同時に進行し、①のH3O+と②のOH-は中和し合い、HPO42-とH3PO4の濃度がある程度まで上昇すると平衡に達する。
平衡状態では、[HPO42-]≒[H3PO4]と近似できる。
以上のことに基づき、結果的に、リン酸二水素一ナトリウム(NaH2PO4)の水溶液のpHは、
溶質が1つの両性電解質だけの水溶液のpHの計算として、
次のようにリン酸のKa1×Ka2より計算することができる。
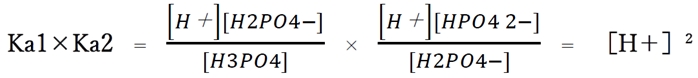

このように、溶質が1つの両性電解質だけの水溶液のpHは両性電解質の濃度に関係しない。
◆ 3について
3 ○ 水酸化ナトリウム水溶液を9.00mL加えたとき、滴定溶液のpHは約8.2である。
0.100 mol/Lリン酸二水素一ナトリウム(NaH2PO4)の水溶液10.00mLに0.100 mol/L水酸化ナトリウム9.00mLを加えると、下記の(1)の反応が進む。
NaH2PO4 + NaOH → Na2HPO4 + H2O …(1)
反応前後の各化学種の物質量は下記の通り
NaH2PO4とNa2HPO4は水中ではほとんど解離している。
NaH2PO4 → H2PO4- + Na+
Na2HPO4 → HPO4 2- + 2Na+
よって、混合後の水溶液は、
H2PO4-が0.1mmol/20mL,
HPO4 2-が0.9mmol/20mLの濃度で存在していると考えられる。
混合後の水溶液は、弱酸のH2PO4-とその共役塩基の塩(Na2HPO4)から成る緩衝液である。
弱酸とその共役塩基の塩の緩衝液のpHは、
以下のように弱酸のヘンダーソン・ハッセルバルヒの式を用いて求められる。

◆ 4について
4 〇 水酸化ナトリウム水溶液を10.00mL加えたとき、滴定溶液のpHは約9.8である。
0.100 mol/Lリン酸二水素一ナトリウム(NaH2PO4)の水溶液10.00mLに0.100 mol/L水酸化ナトリウム10.00mLを加えると、下記の①の反応が進む。
NaH2PO4 + NaOH → Na2HPO4 + H2O …(1)
反応前後の各化学種の物質量は下記の通り
よって、記述4の滴定後の溶液は、リン酸一水素二ナトリウム(NaH2PO4)の単独の水溶液であり、このpHを求める。
リン酸一水素二ナトリウムは両性電解質である。
まず、リン酸一水素二ナトリウム(NaH2PO4)は、水中ではほとんどがHPO4 2-と2Na+に電離する。
そして、HPO4 2-は、下記のように水中で酸または塩基となる。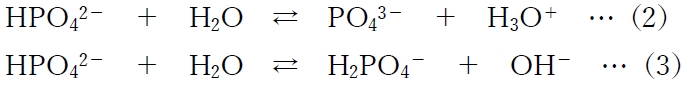
(2)と(3)の反応が同時に進行し、(2)のH3O+と(3)のOH-は中和し合い、H2PO4-とPO4 3-の濃度がある程度まで上昇すると平衡に達する。
平衡状態では、[PO4 3-]≒[H2PO4-]と近似できる。
以上のことに基づき、結果的に、リン酸一水素二ナトリウム(NaH2PO4)の水溶液のpHは、
溶質が1つの両性電解質だけの水溶液のpHの計算として、
次のようにKa2×Ka3より計算することができる。
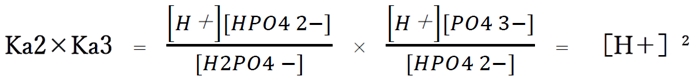
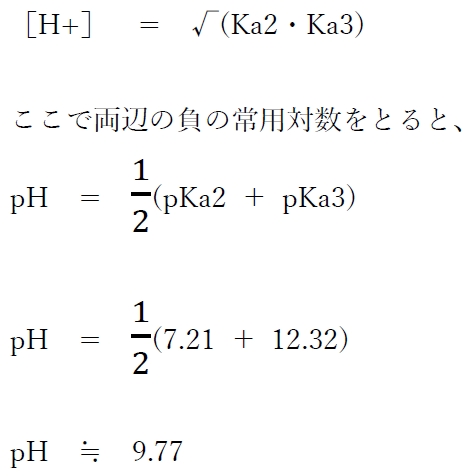
◆ 5について
5 × この滴定の終点(10.00 mL 付近)の検出には、pH指示薬としてメチルオレンジが適している。
→ 〇 この滴定の終点(10.00 mL 付近)の検出には、pH指示薬としてフェノールフタレインが適している。
中和滴定では、pHジャンプの範囲内に変色範囲がある酸塩基指示薬を選択する。
本問の滴定の当量点のpHは約9.8なので、変色範囲が合致する指示薬が適する。
メチルオレンジ:変色域3.1~4.4:酸性色赤-塩基性色オレンジ
メチルレッド:変色域4.2~6.2:酸性色赤-塩基性色黄
フェノールフタレイン:変色域8.3~10.0:酸性色無色-塩基性色紅-強塩基性色無色
★他サイトさんの解説へのリンク
105回問96(e-RECさん)
★ 参考外部サイトリンク
中和滴定(化学のグルメさん)