0.01mol/L塩化アンモニウム水溶液のpH 103回薬剤師国家試験問96
第103回薬剤師国家試験 問96
0.01mol/L 塩化アンモニウム水溶液のpHに最も近い値はどれか。1つ選びなさい。
1 3.65
2 5.65
3 8.35
4 9.30
5 10.35
103回薬剤師国家試験 問96 解答解説
正解は2の5.65である。
本問は、強酸と弱塩基の中和反応で生成する塩の水溶液のpHの計算である。
強酸と弱塩基の塩である塩化アンモニウムは、
水中ではほぼ完全に解離している。
NH4Cl → NH4+ + Cl-
アンモニウムイオンNH4+は水中で弱酸として働く。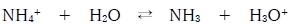
よって、本問では、
弱酸であるNH4+の水溶液としてpHを計算すれば良い。
ある弱酸の水溶液の水素イオン濃度について、次式が成り立つ。
なお、Kaを弱酸の酸解離定数,Cを弱酸の濃度とする。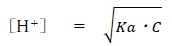
この式は重要なので必ず覚える。
この式を本問のNH4+に適応する。
まず、NH4+の酸解離定数Kaを求める。
酸の酸解離定数Kaとその共役塩基の塩基解離定数Kbと水のイオン積Kwについて、
次式が成り立つ。
Ka×Kb = Kw …①
酸をNH4+とすると、
その共役塩基はNH3なので、次式が成り立つ。
(NH4++のKa)×(NH3のKb) = Kw
ここで、
アンモニアのpKbが4.70なので、アンモニアのKbは1.00×10-4.70 (mol/L)である。
また、水のイオン積Kwは1.00×10-14(mol/L)2である。
よって、NH4+のKaは次のように求められる。
(NH4++のKa)×(NH3のKb) = Kw
(NH4++のKa)× 1.00×10-4.70 (mol/L) = 1.00×10-14(mol/L)2
(NH4++のKa) = 1.00×10-9.30(mol/L)
次に、NH4+の濃度を求める。
NH4Clは次のように電離する。
NH4Clは完全に電離するが、
NH4+はほとんど電離しない。
よって、0.01mol/L 塩化アンモニウム水溶液のNH4+の濃度は0.01 mol/Lと考えられる。
以上より、本問の水素イオン濃度は次のように計算できる。
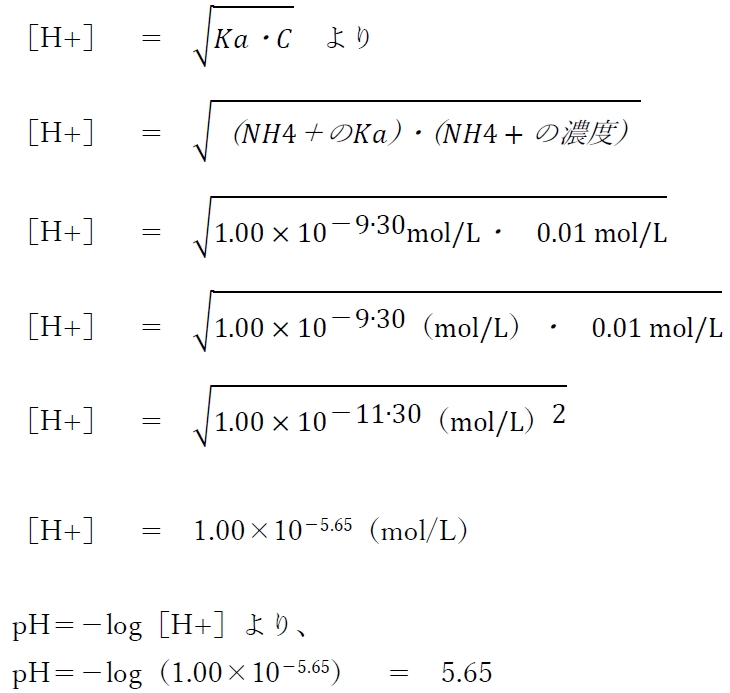

★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)
pHの計算(弱酸・弱塩基溶液)(役に立つ薬の情報~専門薬学さん)
★他サイトさんの解説へのリンク
103回問96(e-RECさん)