酸素化学種の分子軌道 電子配置 薬剤師国家試験103回問100
103回薬剤師国家試験 問100
図は、ある酸素化学種の分子軌道のエネルギー準位と電子配置を模式的に表したものである。この酸素化学種はどれか。1つ選びなさい。

1 一重項酸素 2 三重項酸素 3 スーパーオキシド(O2−)
4 過酸化物イオン(O22−) 5 オゾン
103回薬剤師国家試験 問100 解答解説

正解は、選択肢3のスーパーオキシド(O2−)である。
総電子数を数えると17個であることから、これはスーパーオキシド(O2−)のものであるとわかる。
スーパーオキシド(O2−)は、1つにつき8個の電子を持つ酸素原子が2つあり、かつ、1価の陰イオンで電子を1つ受け取っている状態なので、総電子数が17個である。
他の選択肢について
一重項,三重項の電子の入り方は下記の通り。
一重項:2つの電子が、1つの軌道に互いにスピンの向きを逆平行にして入る状態
三重項:2つの電子が、それぞれ別の軌道に互いにスピンの向きを平行にして入る状態
◆1:一重項酸素
1の一重項酸素(1O2)は、総電子数が16個であり、
π2p*軌道の電子の入り方は下記の通り。
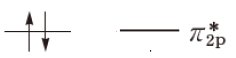
このように、一重項酸素では、
2つあるπ2p*軌道の片方に、2個の電子が2つとも入る。
一重項酸素では、空のπ2p*軌道が1つあるので、ここへ入る電子を強く欲しがる。
そのため、一重項酸素(1O2)は、後述する三重項酸素(3O2)に比べ、反応性が高く、不安定だと考えられる。
◆2:三重項酸素
2の三重項酸素(3O2)は、総電子数が16個であり、
π2p*軌道の電子の入り方は下記の通り。

このように、三重項酸素では、
2つのπ2p*軌道に、電子が1つずつスピンの向きを同じにして入る。
ほとんどの分子では、一重項の状態がより安定であるので、通常、一重項となっている。
しかし、酸素分子は例外で、三重項の方がより安定であるので、
通常、酸素分子は三重項(3O2)となっている。
◆4:過酸化物イオン(O22−)
4の過酸化物イオン(O22−)は総電子数が18個であり、
π2p*軌道の電子の入り方は下記の通り。

★参考外部サイトリンク
活性酸素の生化学pdf(徳島大学さん)
フリーラジカルと活性酸素(Tidbits -ちびっつ-さん)
★他サイトさんの解説へのリンク
103回問100(e-RECさん)