活性化エネルギーが高いほど反応速度に対する温度の影響は大きい 102回薬剤師国家試験問91の5
102回薬剤師国家試験 問91の5
以下の化学反応式における熱力学的パラメータに関する記述の正誤を判定してみよう。
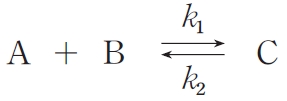
ただし、この反応における温度をT 、反応速度定数をk1,k2とする。また、気体定数をR とする。
5 活性化エネルギーが高いほど反応速度に対する温度の影響は大きい。
薬剤師国家試験過去問題集 アレニウス式・エネルギー図 一覧へ
102回薬剤師国家試験 問91の5 解答解説
5 〇 活性化エネルギーが高いほど反応速度に対する温度の影響は大きい。
反応速度定数kと絶対温度Tの関係式である
アレニウス式について、

いくつかの温度で反応速度定数(k)を測定し、
絶対温度の逆数(1/T)に対して反応速度定数の自然対数(lnk)をプロットすると直線が得られる。
これをアレニウスプロットと呼ぶ。
Aは頻度因子と呼ばれる定数であり、
温度が無限大に高い時の反応速度定数kとされ、
反応速度定数kと同じ単位を持つ。
①式より、アレニウスプロットの直線の傾きは(-Ea/R)であり、
y切片は頻度因子の自然対数(lnA)である。

アレニウスプロットの直線を分析すると、
傾きから活性化エネルギー(Ea)が求められ、
y切片から頻度因子(A)が求められる。
活性化エネルギー(Ea)が高いほど、
アレニウスプロットの直線の勾配は急になり、
温度変化に対する反応速度定数kの変化の度合いは大きくなる。
よって、設問の記述通り「活性化エネルギーが高いほど反応速度に対する温度の影響は大きい」といえる。