90回薬剤師国家試験問3 アレンのπ結合の直交,ピロール窒素の非共有電子対
第90回薬剤師国家試験 問3
混成軌道または化学結合に関する下記の記述の正誤を判定してみよう。
a ベンズアルデヒドの炭素原子は、全てsp2混成軌道を有している。
b アンモニアの窒素原子の軌道は、sp2混成軌道である。
c ピロールの窒素原子上の非共有電子対は、sp3混成軌道を占めている。
d アレン(プロパジエン)の2つのπ結合は、互いに直交している。
第90回薬剤師国家試験 問3 解答解説
◆ aについて
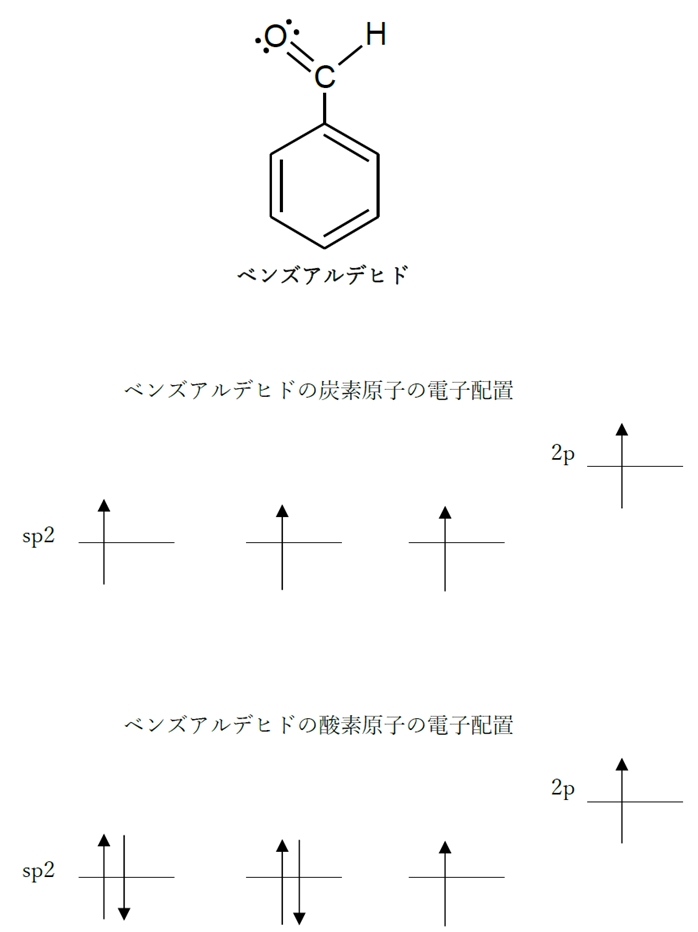
a 〇 ベンズアルデヒドの炭素原子は、全てsp2混成軌道を有している。
ベンズアルデヒドの炭素原子には、ベンゼン環を構成する炭素とアルデヒド基を構成する炭素があるが、いずれもsp2混成軌道を有している。
◆ bについて
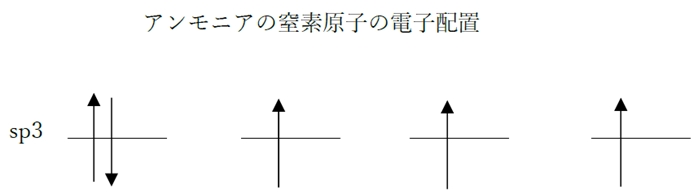
b × アンモニアの窒素原子の軌道は、sp2混成軌道である。
→ 〇 アンモニアの窒素原子の軌道は、sp3混成軌道である。

◆ cについて
c × ピロールの窒素原子上の非共有電子対は、sp3混成軌道を占めている。
→ 〇 ピロールの窒素原子上の非共有電子対は、2p軌道を占めている。
ピロールの窒素原子では、sp2混成軌道をとっているが、非共有電子対は2p軌道に1対収容されており、これによってピロール環のπ電子数が6個となり、ヒュッケル則のπ電子数の条件である4n+2個を満たすので、ピロール環は芳香族性を示す。また、ピロールのN原子の2pの非共有電子対は、実際はピロール環を非局在化しているため他の原子に供与できるものではなく、結果、ピロールは塩基性を示さない。
ピロールとピリジンの比較について下記のリンク先を参照
ピリジンとピロール 非共有電子対の軌道 88回問8c
◆ dについて
d 〇 アレン(プロパジエン)の2つのπ結合は、互いに直交している。
アレン(プロパジエン)は、H2C=C=CH2 という構造であるが、中央の炭素はsp混成軌道と2つの2p軌道を有している。この2つの2p軌道は、結合軸に対して垂直であり、また、2p軌道同士で互いに垂直である。
アレンの中央炭素の2つの2p軌道はそれぞれ両端炭素の2p軌道とπ結合を形成している。
中央炭素の2つの2p軌道は互いに垂直なので、これらがそれぞれ形成する2つのπ結合は互いに直交する。
