92回薬剤師国家試験問2 第二周期元素と水素原子との結合角の大小
第92回薬剤師国家試験 問2
次の化合物又は化学種における、第二周期元素と水素原子との結合角の大小について、正誤を判定してみよう。
a アンモニア > 水
b ボラン > アンモニア
c メタン > メチルカチオン
d メチルアニオン > メチルラジカル
第92回薬剤師国家試験 問2 解答解説
★参考外部サイトリンク
sp3、sp2、sp混成軌道の見分け方とヒュッケル則(役に立つ薬の情報〜専門薬学さん)
◆ aについて
a 〇 アンモニア107° > 水104.5°
アンモニアのH−N−Hと水のH−O−Hの結合角の比較である。
アンモニアの窒素と水の酸素はどちらもsp3混成軌道をとっている。
ある原子がsp3混成軌道をとっているとき、その原子のsp3混成軌道同士が互いに109.5°の結合角を形成し、全体で正四面体を形成するように軌道が伸びる。それは、sp3混成軌道同士が互いに109.5°を形成している配座が最もエネルギーが低く安定だからである。
ただし、非共有電子対が存在すると、sp3の結合角は理想角の109.5°より狭くなる。
アンモニアはsp3に非共有電子対が1つあるせいで、H−N−Hの結合角は約107°である。
結合角が狭くなる理由について、非共有電子対と共有電子対との間の反発は共有電子対同士の反発よりも大きいためと説明される。
H2Oはsp3に非共有電子対が2つあるせいで、結合角がさらに狭くなりH−O−Hの結合角は約104.5°となると説明される。

★ 水のH−O−H結合角が104.5°であることの新たな説明
水の酸素原子はsp3混成軌道を形成していないと主張する説がある。同一周期では、原子番号が大きくなるほど2sと2p軌道のエネルギー差が大きくなり、酸素ではこの差が大きいので2sと2pの混成が起こりにくい。
この説によると、水の酸素は2p軌道で水素と共有結合を形成すると考える。その場合、H−O−Hの結合角は単純に行くと90°であるが、
O−Hの共有結合は極性が大きくイオン結合性を帯びるため、O−H同士が互いに強く反発すること、また、
酸素の有する非共有電子対と水素原子核が相互作用すること、
等の要因から、水のH−O−H結合角は104.5°となると説明する。
◆ bについて
b 〇 ボラン120° > アンモニア107°
sp2混成軌道は同一平面上で正三角形を形成するように伸び、結合角は120°である。
ボラン(BH3)のホウ素原子はsp2混成軌道を取っているので、H−B−Hの結合角は120°である。
 のホウ素原子は、sp2混成である.jpg)
アンモニアの窒素はsp3混成軌道を取っているが、非共有電子対の存在により、H−N−Hの結合角はsp3の理想角の109.5°よりすこし狭い107°である。
◆ cについて
c × メタン > メチルカチオン
→ 〇 メチルカチオン120° > メタン109.5°
メタンの炭素原子はsp3混成軌道をとっており、H−C−Hの結合角は約109.5°である。

メチルカチオン(H3C+)の炭素(C+)はsp2混成軌道をとっており、H−C−Hの結合角は120°である。

◆ dについて
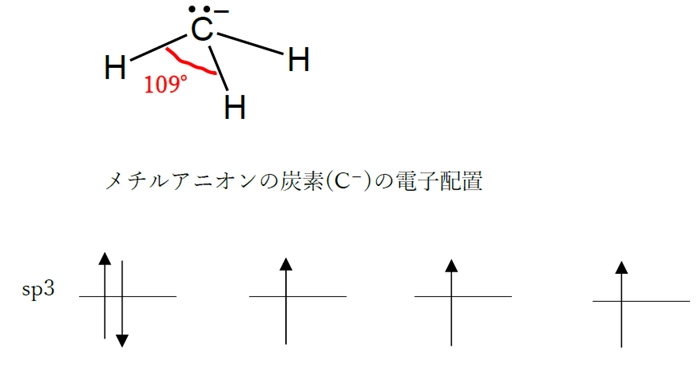
d × メチルアニオン > メチルラジカル
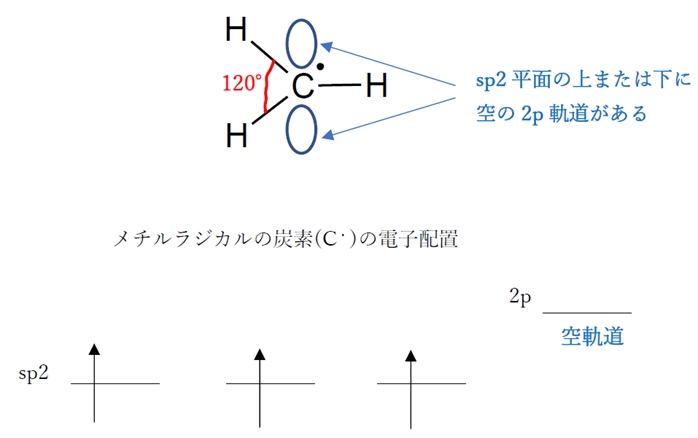
→ 〇 メチルラジカル120° > メチルアニオン109°
メチルアニオン(H3C−)の炭素(C−)はsp3混成軌道をとっており、H−C−Hの結合角は約109°である。
メチルアニオンでは炭素が非共有電子対を持つが、結合角は理想角の109.5°に近いと考えられている。
メチルラジカルH3C・の炭素(C・)はsp2混成軌道をとっており、H−C−Hの結合角は120°である。