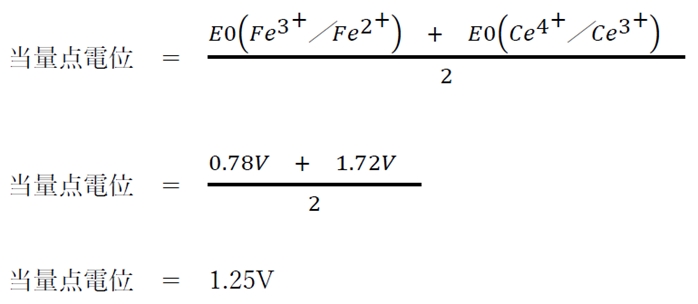Fe2+とCe4+の混合溶液の酸化還元平衡 95回薬剤師国家試験問18
第95回薬剤師国家試験 問18
次の酸化還元平衡式に関する記述の正誤を判定してみよう。
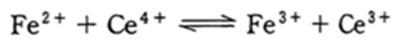
なお、この反応の酸化還元電位 ( E ) は、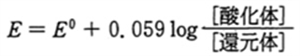
で示され、
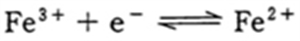
および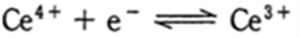
の標準酸化還元電位(E0)は、
それぞれ0.78Vおよび1.72Vである。
a 標準酸化還元電位(E0)は、[酸化体]:[還元体] = 1:1のときの電位である。
b Fe2+とCe4+の混合溶液では、反応は右に進む。
c Fe2+をCe4+で滴定すると、当量点における電位は1.25 Vである。
d Fe2+とCe4+の混合溶液では、Ce4+が還元剤として働き、Fe2+が酸化剤として働く。
第95回薬剤師国家試験 問18 解答解説
◆ aについて
a 〇 標準酸化還元電位(E0)は、[酸化体]:[還元体] = 1:1のときの電位である。
ネルンスト式
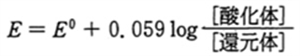
において、
[酸化体]:[還元体] = 1:1 の時、
E=E0 が成立する。
酸化体・還元体については下記のリンク先を参照
酸化体・還元体とは
標準酸化還元電位については下記のリンク先を参照
標準酸化還元電位とは
◆ bとdについて
b 〇 下記の酸化還元反応について、Fe2+とCe4+の混合溶液では、反応は右に進む。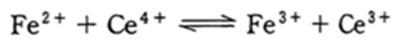
d × Fe2+とCe4+の混合溶液では、Ce4+が還元剤として働き、Fe2+が酸化剤として働く。
→ 〇 Fe2+とCe4+の混合溶液では、Ce4+が酸化剤として働き、Fe2+が還元剤として働く。
自発的な変化はエネルギーが高い方から低い方へと進む。
電子のエネルギーは電位が低いほど高い。
よって、電子の自発的な流れでは、
電子は電位が低い方から高い方へと流れる。
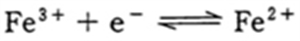
の標準酸化還元電位(E0)は0.78Vで、
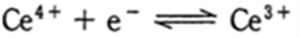
の標準酸化還元電位(E0)は1.72Vである。
E0(Ce4+/ Ce3+) > E0(Fe3+ /Fe2+)
であるため、
(Fe3+/ Fe2+)系と(Ce4+/ Ce3+)系の組み合わせによる酸化還元反応の
自発的な方向性は次の通り。
・相対的に電位の低い(Fe3+/ Fe2+)系から電子が流出する。
つまり、還元体Fe2+が酸化されて酸化体Fe3+が生じる方向(下記の左方向)
へ反応が偏る。
・相対的に電位の高い(Ce4+/ Ce3+)系に電子が流入する。
つまり、酸化体Ce4+が還元されて還元体Ce3+が生じる方向(下記の右方向)
へ反応が偏る。
よって、Fe2+とCe4+の混合溶液では、
下記の全反応の右方向へ偏る。
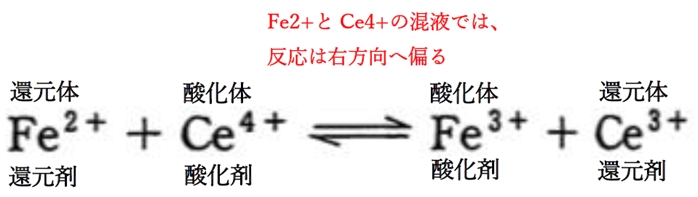
したがって、Fe2+とCe4+の混合溶液では、
「Ce4+は酸化剤として働き、
Fe2+を酸化してFe3+にして、自身はCe3+に還元される」、
または、
「Fe2+は還元剤として働き、
Ce4+を還元してCe3+にして、自身はFe3+に酸化される」。
◆ cについて
c 〇 Fe2+をCe4+で滴定すると、当量点における電位は1.25 Vである。
Fe2+溶液にCe4+溶液を滴加する酸化還元滴定を考える。
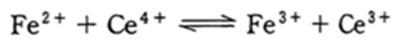
より、
Fe2+とCe4+は1:1で反応し、Fe3+とCe4+が生成する。
Fe2+をCe4+で滴定すると、
当量点では、
[Fe2+]=[Ce4+]
および
[Fe3+]=[Ce3+]
このことから、
ネルンストの式より、
当量点では次のことが成り立つ。