分配平衡と化学ポテンシャル 薬剤師国家試験87回問16ac
第87回薬剤師国家試験 問16ac
互いに混ざり合わない水相と有機溶媒相間での,溶質の分配平衡に関する記述の正誤を判定してみよう。
a 分配平衡では,溶質の各相での化学ポテンシャル(部分モル自由エネルギー)は等しい。
c 分配係数C(oil)/C(water)は,有機溶媒相と水相間の溶質の標準化学ポテンシャル差によって決まる。
第87回薬剤師国家試験 問16ac 解答解説
a 〇 分配平衡では,溶質の各相での化学ポテンシャル(部分モル自由エネルギー)は等しい。
c 〇 分配係数C(oil)/C(water)は,有機溶媒相と水相間の溶質の標準化学ポテンシャル差によって決まる。
☆ 分配平衡と分配係数KD
2つの互いに混ざり合わない溶媒AとBによる二液相において、ある溶質Sの化学種Ⅰ形(SⅠ)が2つの溶媒に分配されるとき、平衡状態では溶媒AにおけるSⅠの濃度([SⅠ]A)と溶媒BにおけるSⅠの濃度([SⅠ]B)の比が一定の決まった値と等しくなるよう溶質SⅠは分配される。これを分配則と呼ぶ。
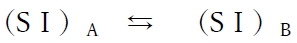
上記の分配平衡の平衡定数を真の分配係数KDと呼び、次式が成り立つ。
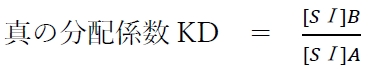
溶媒AとBによる二液相において、ある溶質Sの化学種Ⅰ形(SⅠ)が分配されるとき、平衡状態では[SⅠ]Aと[SⅠ]Bの比が真の分配係数KDの値と等しくなる。
真の分配係数KDは、使用する溶媒,温度,圧力が一定ならば、溶質の化学種ごとに固有の一定値を示す。
☆ 分配と化学ポテンシャル
互いに混ざり合わない水と有機溶媒(oil)から成る二液相における、ある溶質Sの化学種Ⅰ形(SⅠ)の分配について、化学ポテンシャルに関する事項を説明する。
化学ポテンシャルの概要については、別ページで解説させていただいている。
化学ポテンシャルの概要 へ

添え字のwは水相,oは有機相を表すとする。
水相中の溶質SⅠの化学ポテンシャルをμwで記し、
有機相中の溶質SⅠの化学ポテンシャルをμoで記す。
μwは、定温定圧下、水中の溶質SⅠの単位量の変化に対する系の自由エネルギー変化量である。
単位量を1molとすれば、μwは水中の溶質SⅠの部分モル自由エネルギーに等しい。
μoは、定温定圧下、有機溶媒中の溶質SⅠの単位量の変化に対する系の自由エネルギー変化量である。
各成分の化学ポテンシャルμと各成分のモル分率Xの関係式として、次式が成り立つ。
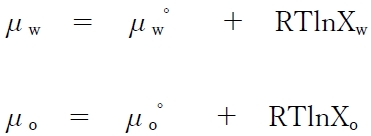
μw゜およびμo゜は、それぞれ水相および有機相の溶質SⅠの標準化学ポテンシャルという定数である。
ここでの標準化学ポテンシャルはどういったものかを考える。
μw゜は、標準圧力下で水に溶質SⅠが溶解している理想希薄溶液における溶質SⅠが置かれている状態を想定し、その溶質SⅠの状態を維持したまま溶質SⅠのモル分率を1とした時の溶質SⅠの化学ポテンシャルという仮想的なものである。
μo゜は、上記のμw゜のことを有機溶媒中のことに置き換えたものである。
溶媒が異なれば溶質SⅠの置かれている状態は異なるので、μw゜とμo゜は異なる。
自発的な変化では、化学ポテンシャルの高い方から低い方へと物質の移動・変化が起こる。
各成分の化学ポテンシャルが等しくなると、見かけ上、物質の移動・変化は止まる。これが平衡状態である。
平衡状態では、各成分の化学ポテンシャルは等しい。
水と有機溶媒での溶質SⅠの分配平衡では、μwとμoは等しい。
よって、次が成り立つ。
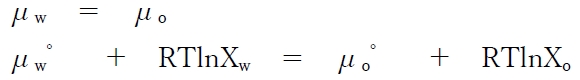
これを変形すると、次式が成り立つ。
なお、真の分配係数KDについて次が成り立つとする。
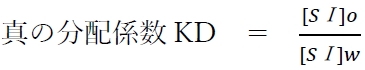
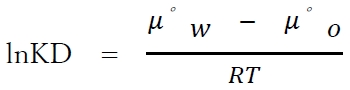
以上より、
分配平衡について、
定温,定圧下での分配係数KDは、それぞれの液相における溶質の標準化学ポテンシャル(μ゜)の差によって決まるといえる。
★参考外部サイトリンク
分配平衡(yakugaku labさん)