中性アミノ酸 pHの変化に対する化学種の存在比(割合),荷電と等電点
本ページでは、中性アミノ酸におけるpHの変化に対する解離,各化学種の存在比(割合)の変化,荷電状態,および等電点について説明しています。
pHを低い状態から上げていくことによる中性アミノ酸の酸解離の様子を述べる。
便宜的に各化学種をⅠ~Ⅲ型と呼ぶことにする。
① カルボキシ基の酸解離平衡
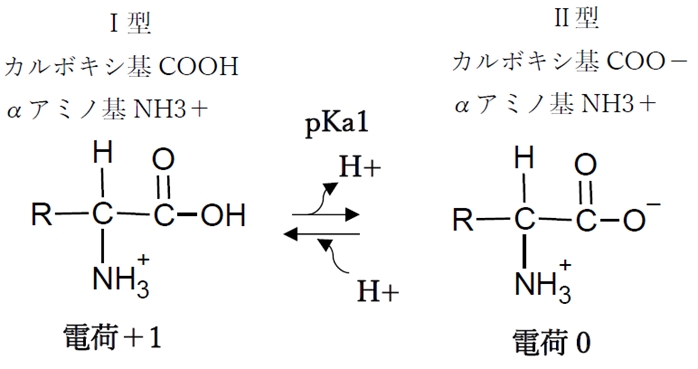
カルボキシ基の酸解離平衡のKa,pKaをKa1,pKa1と表す。
② アミノ基の酸解離平衡
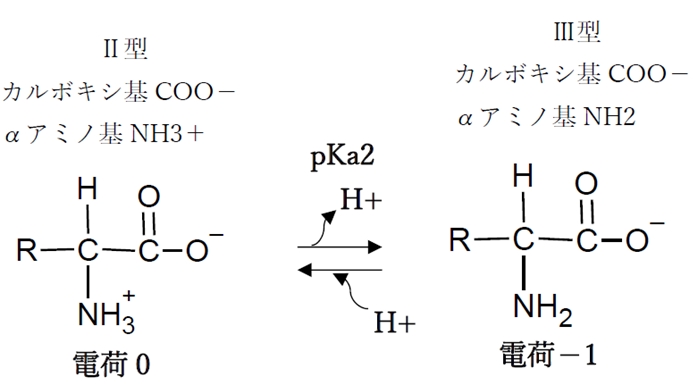
アミノ基の酸解離平衡のKa,pKaをKa2,pKa2と表す。
〇 中性アミノ酸の等電点について
ある物質について、主に電荷0の化学種として存在し、見かけ上電荷を持たなくなる時のpHを、その物質の等電点と呼ぶ。
中性アミノ酸では、カルボキシ基がCOO-で負電荷を帯び、かつ、アミノ基がNH3+で正電荷を帯びている化学種は、分子内の電荷が±0である。

中性アミノ酸では、pHが(pKa1+pKa2)/2と等しい時、見かけ上電荷を持たなくなることから、中性アミノ酸の等電点は(pKa1+pKa2)/2であるといえる。
言い換えると、pHがその中性アミノ酸の等電点の(pKa1+pKa2)/2に等しい時、その中性アミノ酸は見かけ上電荷を持たなくなる(電荷が±0になる)といえる。
以上のことに基づき、
下の図を参考に、点Fから出発して徐々にpHを上げていくことを想定し、溶液のpHの変化に対する中性アミノ酸の各化学種の存在割合の変化を考えてみる。

・点F
Ⅰ型がほぼ100%を占める
・点A
点AのpH=pKa1
Ⅰ型とⅡ型が50%ずつ占める。
・点D
点DのpH=(pKa1+pKa2)/2
Ⅱ型(電荷0の化学種)がほぼ100%を占める。
よって、点DのpHは等電点に該当する。
・点B
点BのpH=pKa2
Ⅱ型とⅢ型が50%ずつ占める。
・点B以上のpH
pHが上がるにつれてⅡ型からⅢ型に変わるものが増えていき、
いずれⅢ型がほぼ100%を占める状況になると考えられる。