弱酸性物質におけるpHの変化に対する溶解度の変化 薬学 物理・薬剤
本ページでは、弱酸性物質におけるpHの変化に対する溶解度の変化について説明しています。
● 1価の弱酸性物質におけるpHの変化に対する溶解度の変化について
物質の溶解度とは、その物質の一定量の溶媒に溶解する最大量である。物質の溶解度は、その物質の飽和溶液における全ての化学種の濃度の総和に等しい。
溶解度=飽和溶液における全ての化学種の濃度の総和
物質の溶解度について考える時は、飽和溶液を想定する。
ある物質の飽和溶液とは、溶媒中に溶けていない分(固相)が存在し、なおかつ、溶解平衡が成立している溶液であり、その状態の溶液の濃度を飽和濃度という(過飽和の時を除く)。
ここで、分子形とイオン形の2種の化学種になり得る弱電解質の溶解度について述べる。なお、イオン形は全て溶解するものとする。
便宜的に、飽和溶液における分子形の濃度とイオン形の濃度をそれぞれ[分子形]飽,[イオン形]飽と表すとする。そうすると、この弱電解質の溶解度について次が成り立つ。
弱電解質の溶解度= [分子形]飽 + [イオン形]飽
弱電解質の溶解度は溶液のpHによって変化する。
弱電解質の飽和溶液における分子形の濃度([分子形]飽)はpHによって変化せず一定値である。
一方、弱電解質の飽和溶液におけるイオン形の濃度([イオン形]飽)はpHによって変化する。
よって、弱電解質の溶解度がpHによって変化するのは、[イオン形]飽がpHによって変化するためである。
以下では、弱酸性物質におけるpHの変化に対する溶解度の変化について述べる。
〇 1価の弱酸性物質の飽和溶液におけるpHの変化に対する分子形濃度とイオン形濃度の変動について
飽和溶液では溶解平衡が成立している。溶解平衡とは、溶媒中の溶解していない結晶(固相)と溶解しているものとの間の化学平衡である。
弱電解質の飽和溶液では、さらに、溶解している分子形とイオン形との間で酸塩基平衡も成立している。
よって、1価の弱酸性物質の飽和溶液では下記の①と②の2つの化学平衡が成立している。
ある1価の弱酸性物質はHA(分子形)とA-(陰イオン形)の2種の化学種になり得るとする。
① 溶解平衡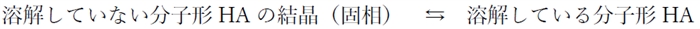
この溶解平衡で大事なことは、固相の量によらず固相が存在する限り、pHが変化しても溶解している分子形の濃度は一定値に保たれるということである。
弱酸性物質の飽和溶液では、溶解している分子形HAの濃度([HA]飽)はpHによって変化せず一定値であることを押さえておこう。
② 酸塩基平衡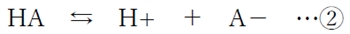
・1価の弱酸性物質の飽和溶液の平衡のイメージ

弱酸性解質の飽和溶液において、溶解平衡のために分子形HAの濃度([HA]飽)はpHによって変化せず一定値であることを先で述べた。
一方、弱酸性物質の飽和溶液における陰イオン形A-の濃度([A-]飽)はpHによって変化する。
②の酸塩基平衡より、pHが上昇すれば陰イオン形A-の濃度は上昇し、pHが低下すれば陰イオン形A-の濃度は低下する。
弱酸性物質の溶解度がpHによって変化するのは、飽和溶液における陰イオン形濃度([A-]飽)がpHによって変化するためである。
ここで、弱酸性物質の飽和溶液においてpHの変化に対して陰イオン形濃度([A-]飽)がどのように変化するのかについて説明する。
ある弱酸性物質は次のように解離し、HAとA-の2種の化学種になり得るとする。
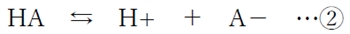
②の酸塩基平衡において、弱酸性物質のヘンダーソン・ハッセルバルヒの式として次式が成り立つ。
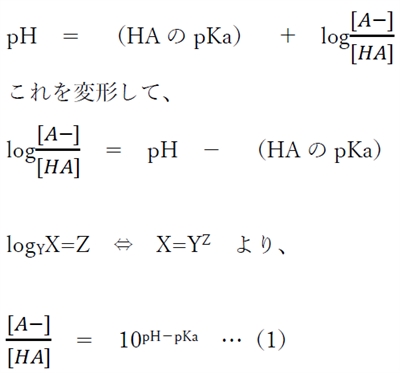
(1)式より、弱酸性物質のあるpHにおける分子形濃度と陰イオン形濃度の比が計算できる。
(1)式において、[HA]=1とすると、
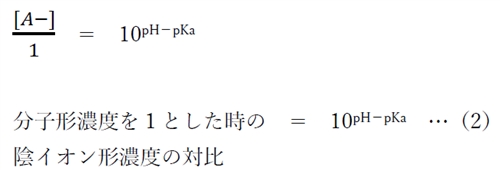
(2)式より、弱酸性物質のあるpHにおける分子形濃度を1としたときの陰イオン形濃度の対比が計算できる。
(2)式より、弱酸性物質の飽和溶液において、pHの変化に対して陰イオン形濃度([A-]飽)がどのように変化するのかが掴める。
このように、弱酸性物質の飽和溶液ではpHの変化に対して陰イオン形濃度([A-]飽)が変化するので、弱酸性物質ではpHの変化に対して溶解度が変化する。
ある1価の弱酸性物質におけるpHの変化に対する溶解度の変化について、
pH=pKa-1
pH=pKa
pH=pKa+1
という3つのpHを例にして、1価の弱酸性物質の飽和溶液のイメージ図を下に示す。
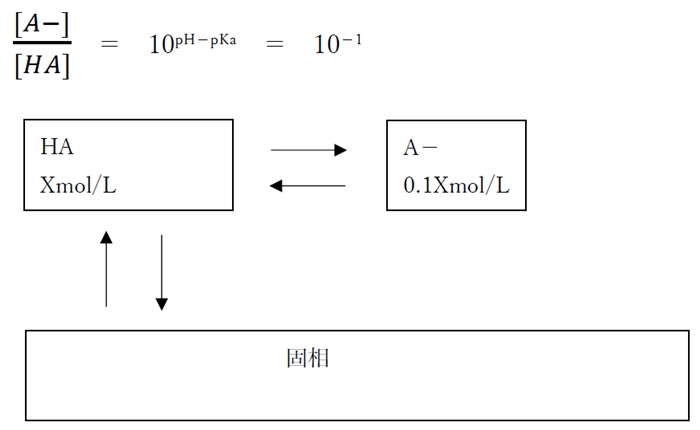
・pH=pKa-1 の時
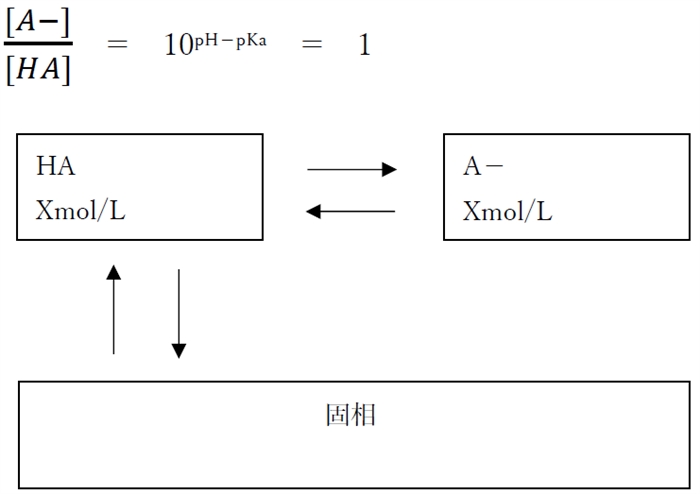
・pH=pKa の時
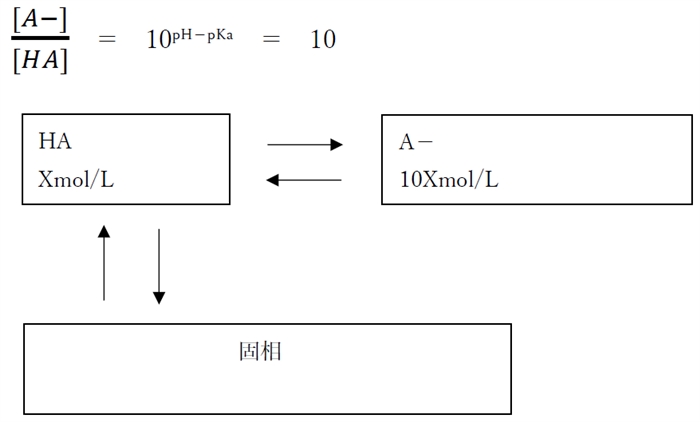
・pH=pKa+1 の時
弱酸性物質の飽和溶液ではpHが変化しても分子形濃度は一定であることに注意する。
以上より、
弱酸性薬物の飽和溶液において、pHの変化に対する各化学種の濃度の変化について、次のことがいえる。
・pHが低下した場合
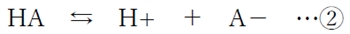
の平衡が左に傾き、A-からHAに変わる反応が促進される。
陰イオン形濃度([A-]飽)はpHが1低下するごとに1/10に低下する。
分子形濃度([HA]飽)について、pH低下で分子形(HA)が増えそうになるが、飽和溶液では溶解平衡で固相になるHAが増えることで、溶解しているHAは一定量に保たれるため、分子形濃度([HA]飽)はpHによらず一定である。
・pHが上昇した場合
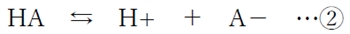
の平衡が右に傾き、HAからA-に変わる反応が促進される。
陰イオン形濃度([A-]飽)はpHが1上昇するごとに10倍に上昇する。
分子形濃度([HA]飽)について、pH上昇で分子形(HA)が減りそうになるが、飽和溶液では溶解平衡で固相からHAが溶けだすことで、溶解しているHAは一定量に保たれるため、分子形濃度([HA]飽)はpHによらず一定である。
〇 弱酸性物質のあるpHにおける溶解度の計算方法
以上は分子形HAと陰イオン形A-の2種の化学種をとり得る弱酸性物質において、pHの変化に対して溶解度がどのように変化するかの説明であった。
以下では、1価の弱酸性物質のあるpHにおける溶解度の計算方法を説明する。
弱酸性物質が次の②のように解離するとする。
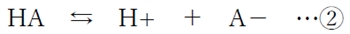
1価の弱酸性物質の溶解度は飽和溶液における分子形濃度([HA]飽)と陰イオン形濃度([A-]飽)の和に等しい。
1価の弱電解質の溶解度= [分子形]飽 + [イオン形]飽
1価の弱酸性物質の溶解度= [HA]飽 + [A-]飽
あるpHにおける溶解度を計算できるようにするために、
この式を元にして「pH」の変数を出現させるために変形していく。
まずは、[A-]飽を変換する。
②より、HAの酸解離定数Kaについて次が成り立つ。

ここで、
pH=-log[H+] より -pH=log[H+]
および
pKa=-logKa より -pKa=logKa
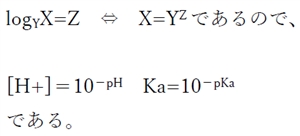

(3)式により、弱酸性物質のあるpHにおける溶解度が計算できる。
弱酸性物質の飽和溶液における分子形濃度を1としたときのイオン形濃度の対比である。これがpHによって変化するので弱酸性物質の溶解度がpHによって変化する。
(3)式を用いて、
1価の弱酸性物質の溶解度について、
pHがpKa-2,pKa-1,pKa,pKa+1,pKa+2 の時の値がどうなるか計算する。
・pH=pKa-2の時の溶解度

・pH=pKa-1の時の溶解度

・pH=pKaの時の溶解度

・pH=pKa+1の時の溶解度

・pH=pKa+2の時の溶解度

以上より、
1価の弱酸性薬物の溶解度について、
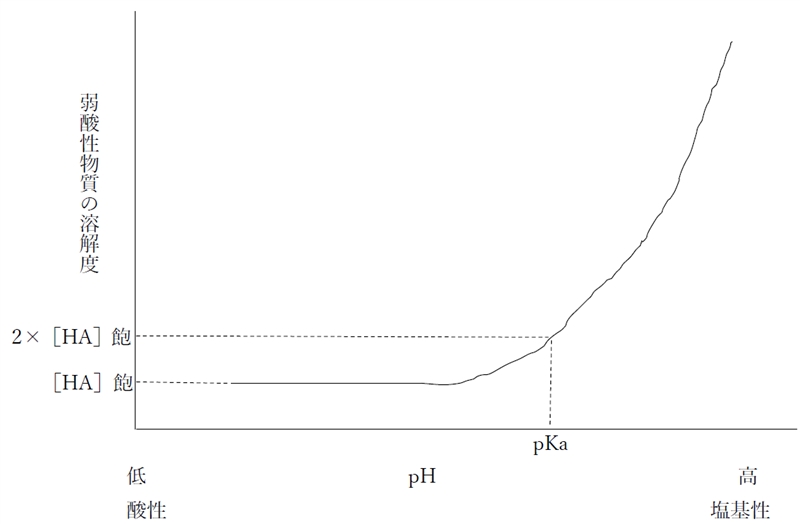
pHがpKaより2以上低い値の場合(pH≦pKa-2)の溶解度は[HA]飽にほぼ等しいとみなせ、
pHがpKaと等しい場合の溶解度は“2×[HA]飽”に等しいとみなせる。
下図は1価の弱酸性物質における溶液のpHと溶解度の関係を示す曲線である。
本ページでは、1価の弱酸性化合物におけるpHの変化に対する溶解度について解説した。
別ページで、1価の弱塩基性化合物におけるpHの変化に対する溶解度の変化について解説しているので、
そちらも参照していただきたい。
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)