あるpHでの弱酸性薬物の分子形:イオン形の存在比 98回薬剤師国家試験問50
第98回薬剤師国家試験 問50
弱酸性薬物の水溶液のpHが、その薬物のpKaより2高いとき、水溶液中の薬物の分子形:イオン形の存在比に最も近いのはどれか。1つ選びなさい。

第98回薬剤師国家試験 問50 解答解説
正解は1の分子形:イオン形=1:100 である。
弱酸性薬物におけるpHの変化に対する各化学種(分子形・イオン形)の存在割合(存在比・分率)の変化についての問題である。
弱酸性物質におけるpHの変化に対する分子形・イオン形の存在比の変化の解説 へ
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取って分子形(HA)になる。A:−を酸(HA)の共役塩基と呼ぶ。
上記の酸塩基平衡を基に、
弱酸性物質について、溶液のpH,HAのpKa,分子形濃度[HA],イオン形濃度[A−]の関係式として、
次のヘンダーソン・ハッセルバルヒの式が成り立つ。

これを変形すると、
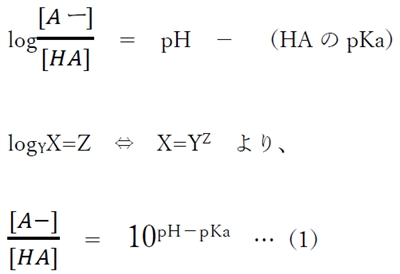
(1)式より、弱酸性物質のあるpHにおけるHA(分子形)とA−(陰イオン形)の存在割合(存在比)を計算できる。
本問では、
弱酸性薬物の水溶液のpHが、
その薬物のpKaより2高いときの分子形:イオン形の存在比を求める。
・pH=pKa+2の時

下図は溶液のpHと1価の弱酸性物質の分子形(HA)および陰イオン形(A−)の存在割合の関係を示す曲線である。
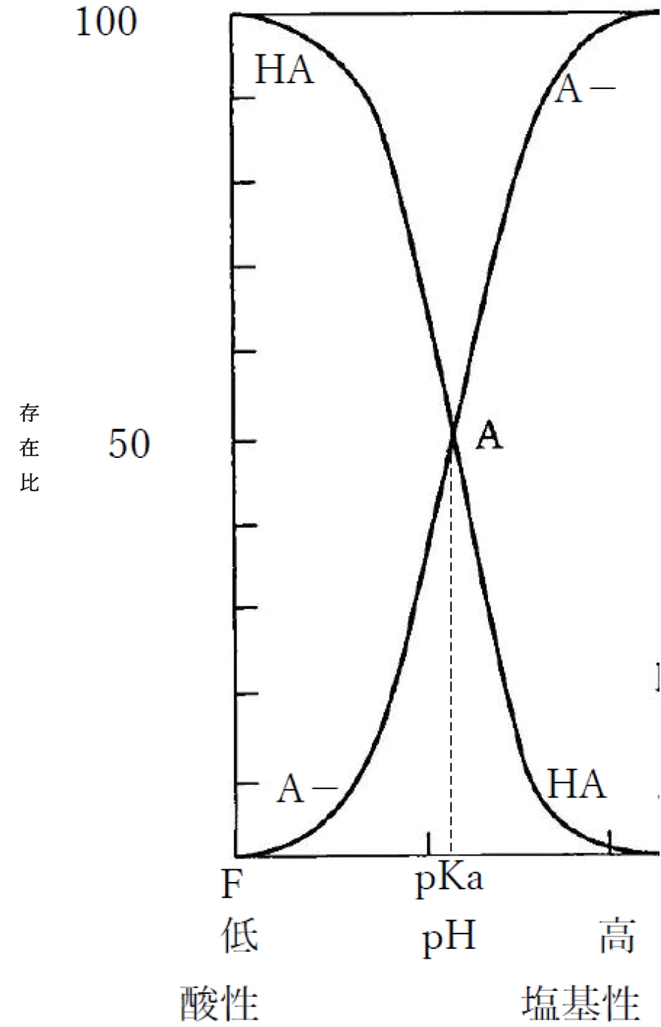
なお、弱塩基性物質におけるpHの変化に対する分子形・イオン形の分率・存在比の変化については、下記の別ページで解説しているので、併せて参照していただきたい。
弱塩基性物質におけるpHの変化に対する分子形・イオン形の存在比(分率)の変化 へ
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)
★他サイトさんの解説へのリンク
98回問50(e-RECさん)