塩基性アミノ酸のうちのリシン,アルギニンの pHの変化に対する化学種の存在比(割合),荷電と等電点
本ページでは、塩基性アミノ酸のうちのリシン,アルギニンにおけるpHの変化に対する解離,各化学種の存在比(割合)の変化,荷電状態,および等電点について説明しています。
pHを低い状態から上げていくことによる塩基性アミノ酸のリシン,アルギニンの酸解離の様子を述べる。
L-アルギニンを例に説明する。
便宜的に各化学種をⅠ~Ⅳ型と呼ぶことにする。
① カルボキシ基の酸解離平衡
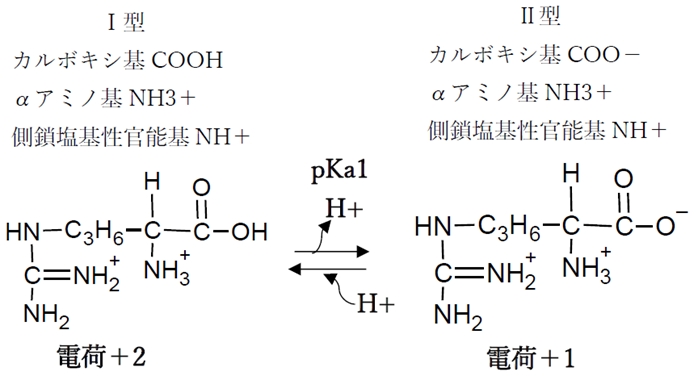
カルボキシ基の酸解離平衡のKa,pKaをKa1,pKa1と表す。
② アミノ基の酸解離平衡
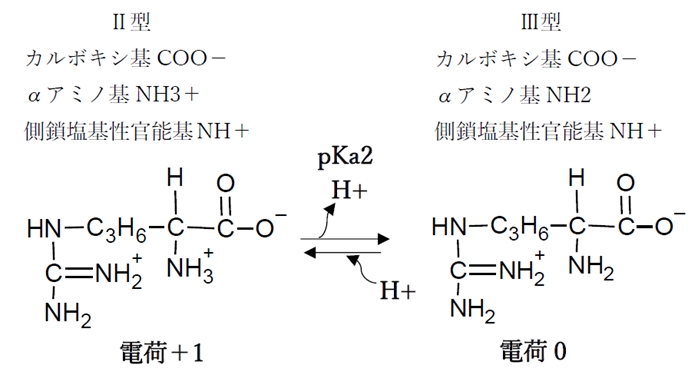
αアミノ基の酸解離平衡のKa,pKaをKa2,pKa2と表す。
L-リシンとL-アルギニンでは、αアミノ基よりも側鎖の塩基性官能基の方が塩基性が強い。それは、αアミノ基の共役酸(NH+)よりも側鎖の塩基性官能基の共役酸(NH+)の方が酸性が弱いことを意味する。
③ 側鎖の塩基性官能基の酸解離平衡
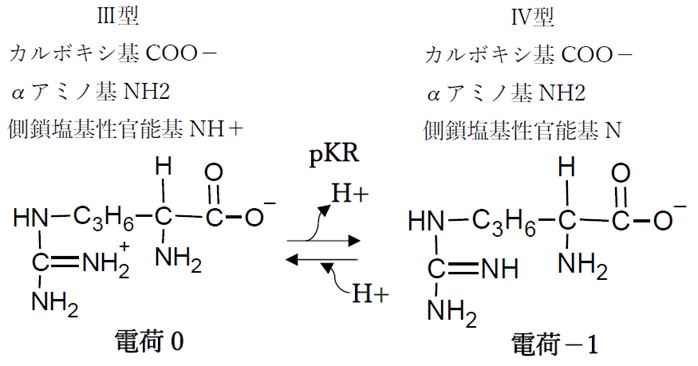
側鎖の塩基性官能基の酸解離平衡のpKaをpKRと表す。
〇 L-リシンとL-アルギニンの等電点について
ある物質について、主に電荷0の化学種として存在し、見かけ上電荷を持たなくなる時のpHを、その物質の等電点と呼ぶ。
塩基性アミノ酸のうちのL-リシンとL-アルギニンでは、1つのカルボキシ基がCOO-で負電荷を帯び、側鎖の塩基性官能基がNH+となり正電荷を帯びている化学種は、分子内の電荷が±0である。

塩基性アミノ酸のうちのL-リシンとL-アルギニンでは、pHが(pKa2+pKR)/2の時、見かけ上電荷を持たなくなることから、L-リシンまたはL-アルギニンの等電点は(pKa2+pKR)/2であるといえる。
言い換えると、pHがL-リシンまたはL-アルギニンの等電点の(pKa2+pKR)/2に等しい時、L-リシンまたはL-アルギニンは見かけ上電荷を持たなくなる(電荷が±0になる)といえる。
以上のことに基づき、
下の図を参考に、点Fから出発して徐々にpHを上げていくことを想定し、溶液のpHの変化に対する塩基アミノ酸のリシン,アルギニンの各化学種の存在割合の変化を考えてみる。

・点F
Ⅰ型がほぼ100%を占める
・点A
点AのpH=pKa1
Ⅰ型とⅡ型が50%ずつ占める。
・点D
点DのpH=(pKa1+pKa2)/2
Ⅱ型がほぼ100%を占める。
・点B
点BのpH=pKa2
Ⅱ型とⅢ型が50%ずつ占める。
・点E
点EのpH=(pKa2+pKR)/2
Ⅲ型(電荷0の化学種)がほぼ100%を占める。
よって、点EのpHは等電点に該当する。
・点C
点CのpH=pKR
Ⅲ型とⅣ型が50%ずつ占める。
・点C以上のpH
pHが上がるにつれてⅢ型からⅣ型に変わるものが増えていき、
いずれⅣ型がほぼ100%を占める状況になると考えられる。