pH が7.4 であるとき、血漿中のHCO3−の濃度は、H2CO3の濃度の何倍か 97回薬剤師国家試験問201
第97回薬剤師国家試験 問201
アセタゾラミドは、HCO3−とH2CO3の濃度バランスを変化させることにより、アシドーシスを引き起こすと考えられている。血漿のpH が7.4 であるとき、血漿中のHCO3−の濃度は、H2CO3 の濃度の何倍か。最も近い値を1つ選びなさい。
ただし、H2CO3は、以下の式に従って解離し、そのpKaは6.1とする。
また、log2 = 0.30、log3 = 0.48とする。
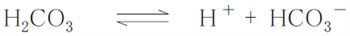
1 0.05
2 1.3
3 10
4 13
5 20
第97回薬剤師国家試験 問201 解答解説
正解は5の20倍である。
弱酸性物質におけるpHの変化に対する各化学種(分子形・イオン形)の存在割合(存在比・分率)の変化についての問題である。
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:−)となり、A:−はプロトンを受け取ってHAになる。A:−を酸(HA)の共役塩基と呼ぶ。
この酸塩基反応の平衡定数をHAの酸解離定数Kaとすると、
酸HAとその共役塩基A−について、次のヘンダーソン・ハッセルバルヒの式が成り立つ。
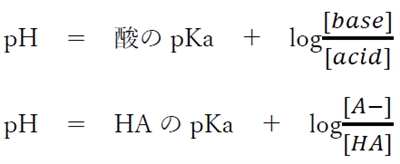
これを変形すると、
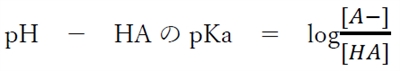
これより、pHとHAのpKaの差がわかれば、 HAとA−の濃度比(存在比)を求めることができる。
以上のことを、酸H2CO3とその共役塩基HCO3−の酸塩基平衡に適用する。
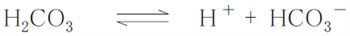
上記の酸塩基平衡について弱酸性物質のヘンダーソン・ハッセルバルヒの式を適用すると、次式が成り立つ。

問題は、H2CO3のpKaは6.1で、血漿のpH が7.4 であるとき、血漿中のHCO3−の濃度は、H2CO3 の濃度の何倍かという計算である。
(2)式に与えられた値を代入すると、
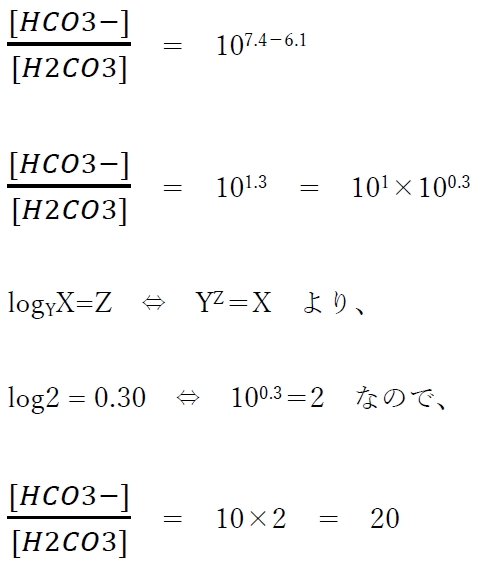
よって、pH=7.4の時、
HCO3−の濃度はH2CO3の濃度の20倍である。
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)
★他サイトさんの解説へのリンク
97回問201(e-RECさん)