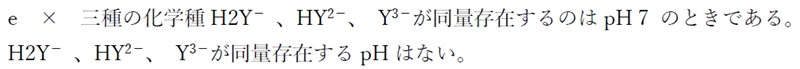90回薬剤師国家試験問17 三塩基酸(H3Y)の各分子種のモル分率とpHの関係
第90回薬剤師国家試験 問17
図は三塩基酸(H3Y)の各分子種のモル分率とpHの関係を示したもの である。次の記述の正誤を判定してみよう。

第90回薬剤師国家試験 問17 解答解説
三塩基酸H3Y溶液の、pHと各化学種のモル分率の関係は下記の通り。
の各分子種のモル分率とpHの関係 90回17.jpg)
a 〇 曲線の交点Aでは、H3YとH2Y−のモル比は1:1である。

以下、詳細
・点F〜点D
の各分子種のモル分率とpHの関係 90回17.jpg)
点F〜点DのpHでは下記の第一段階酸解離平衡反応が動き、H3YとH2Y−の2種で全体の割合を大きく占める。
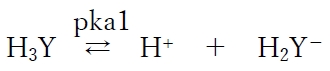
第一段階の酸解離平衡のKa,pKaをKa1,pKa1と表す。
また、この酸解離平衡のKa,pKaを、
H3YのKa,H3YのpKaという表し方もする。
第一段階の酸塩基平衡について、次のヘンダーソン・ハッセルバルヒの式が成り立つ。
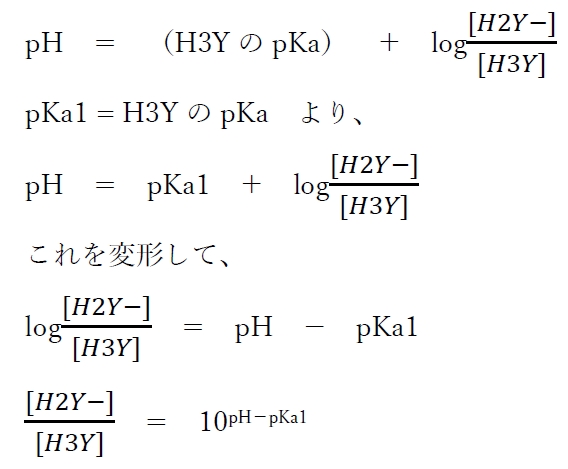
上式より、各pHにおけるH3YとH2Y−の存在比がわかる。
の各分子種のモル分率とpHの関係 90回17.jpg)
点Fでは、この物質はほぼ100%の割合でH3Yとして存在している。
pHが上がるにつれ、H3YからH2Y−に変わるものが増えていく。
pHがH3YのpKa(pKa1)と等しくなると(点A)、H3YとH2Y−とで全体の割合を50%ずつ占める(H3Y:H2Y− = 1:1)。
さらにpHが上がるにつれ、H3YからH2Y−に変わるものが増え、点DのpHではこの物質はほぼ100%の割合でH2Y−として存在している。
点DのpHについて、次式が成り立つ。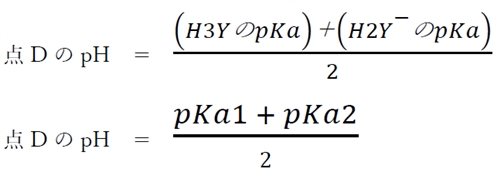
・点D〜点E
の各分子種のモル分率とpHの関係 90回17.jpg)
点D〜点EのpHでは第二段階酸解離平衡反応が動き、H2Y−とHY2−の2種で全体の割合を大きく占める。
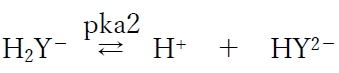
この酸塩基平衡について、次のヘンダーソン・ハッセルバルヒの式が成り立つ。
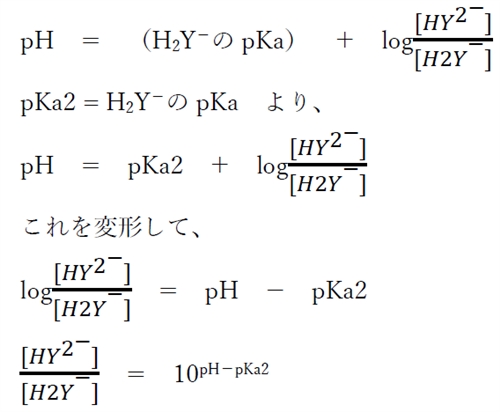
上式より、各pHにおけるH2Y−とHY2−の存在比がわかる。
の各分子種のモル分率とpHの関係 90回17.jpg)
点Dでは、この物質はほぼ100%の割合でH2Y−として存在している。
pHが上がるにつれ、H2Y−からHY2−に変わるものが増えていく。
pHがH2Y−のpKa(pKa2)と等しくなると(点B)、H2Y−とHY2−とで全体の割合を50%ずつ占める(H2Y−:HY2− = 1:1)。
さらにpHが上がるにつれ、H2Y−からHY2−に変わるものが増え、点EのpHではこの物質はほぼ100%の割合でH2Y−として存在している。
点EのpHについて、次式が成り立つ。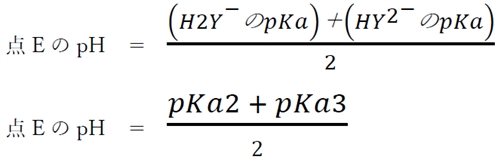
・点E以上のpH
の各分子種のモル分率とpHの関係 90回17.jpg)
点E以上のpHでは第三段階酸解離平衡反応が動き、HY2−とY3−の2種で全体の割合を大きく占める。
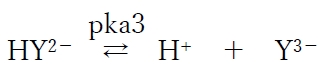
この酸塩基平衡について、次のヘンダーソン・ハッセルバルヒの式が成り立つ。
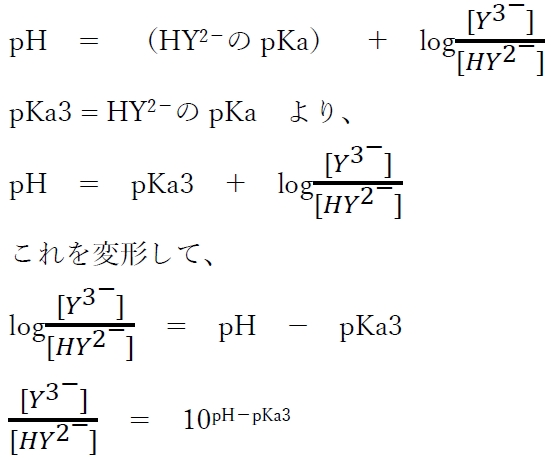
上式より、各pHにおけるHY2−とY3−の存在比がわかる。
点Eでは、この物質はほぼ100%の割合でHY2−として存在している。
pHが上がるにつれ、HY2−からY3−に変わるものが増えていく。
pHがHY2−のpKa(pKa3)と等しくなると(点C)、HY2−とY3−とで全体の割合を50%ずつ占める(HY2−:Y3− = 1:1)。
さらにpHが上がるにつれ、HY2−からY3−に変わるものが増えていき、いずれこの物質はほぼ100%の割合でY3−として存在する状況になる。
以上のことを踏まえ、問題のa〜eの正誤を判定してみる。
・aおよびcについて
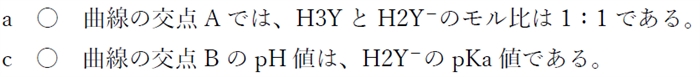
の各分子種のモル分率とpHの関係 90回17.jpg)
A:pH=pka1=H3YのpKa
H3YとH2Y−がH3Y全体を50%ずつで占める。
B:pH=pka2=H2Y−のpKa
H2Y−とHY2−がH3Y全体を50%ずつで占める。
C:pH=pka3=HY2−のpKa
HY2−とY3−がH3Y全体を50%ずつで占める。
・bについて
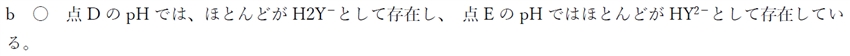
の各分子種のモル分率とpHの関係 90回17.jpg)
・dについて
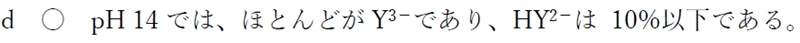
の各分子種のモル分率とpHの関係 90回17.jpg)
・eについて