82回薬剤師国家試験問12 ammoniumionのpKaは10である 負の値のpKaをもつものは特に強い酸である
82回薬剤師国家試験 問12
酸の解離に関する次の記述の正誤を判定してみよう。ただし、数値は正しいものとする。
a acetic acidの下記の平衡式に関して、平衡定数Kと酸解離定数Kaの間には、K=Ka [H2O] の関係がある。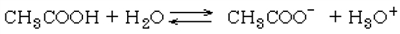
b acetic acidのpKaは4.7である。pH4.7の水溶液中では、CH3COOHとCH3COO-のモル濃度は等しい。
c 「ammoniaのpKaは10である」という記述は正しくない。「ammoniumionのpKaは10である」とするべきである。
d 負の値のpKaをもつものは特に強い酸である。
第82回薬剤師国家試験 問12 解答解説
◆ aについて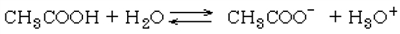
a 〇 acetic acidの下記の平衡式に関して、平衡定数Kと酸解離定数Kaの間には、K=Ka [H2O] の関係がある。
酸となる物質(HA)はプロトン(H+)を放出して陰イオン形(A:-)となり、A:-はプロトンを受け取ってHAになる。A:-を酸(HA)の共役塩基と呼ぶ。
上記①の酸HAと共役塩基A-の酸塩基平衡の平衡定数は下記の通りである。
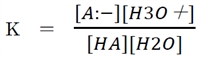
上のKにおいて、一般に水溶液では水の濃度は他よりも圧倒的に高いので、
[H2O](水の濃度)を55.6Mの一定値とし、K×[H2O]=Kaと定める。
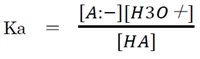
このKaをHAの酸解離定数と呼ぶ。酸解離定数(Ka)は一定条件下でそれぞれの物質が固有の値を示す。
下記のacetic acidの平衡式に関して、平衡定数KとCH3COOHのKaとの間には次の関係がある。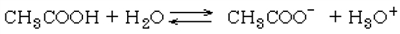

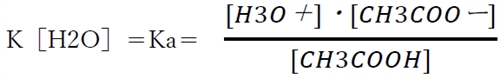
◆ bについて
b 〇 acetic acidのpKaは4.7である。pH4.7の水溶液中では、
CH3COOHとCH3COO-のモル濃度は等しい。
下記の弱酸性物質HAの酸塩基平衡について以下のことが成り立つ。

この式を弱酸性物質のヘンダーソン・ハッセルバルヒの式と呼ぶ。
これを変形すると、
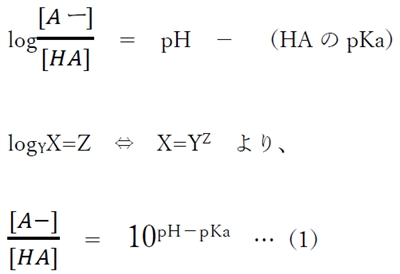
(1)式より、弱酸性物質のあるpHにおけるHA(分子形)とA-(陰イオン形)の存在割合(存在比)がわかる。
以上のことを、下記のacetic acidの酸塩基平衡に適用すると次のことが成り立つ。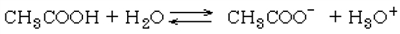
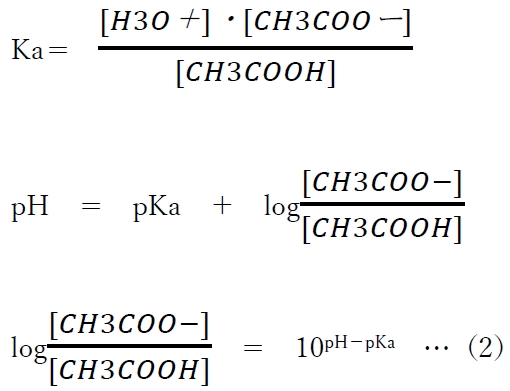
(2)式より、acetic acidのあるpHにおけるCH3COOH(分子形)とCH3COO-(陰イオン形)の存在割合(存在比)がわかる。
(2)式に、pKa=4.7,pH=4.7を代入すると、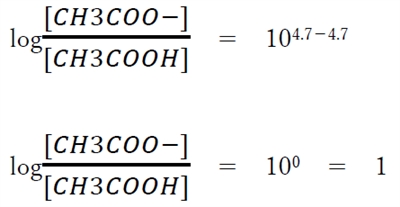
よって、acetic acid(pKa 4.7)は、pH4.7の水溶液中では、
CH3COOHとCH3COO-のモル濃度は等しいといえる。
また、acetic acid(pKa 4.7)は、pH4.7の水溶液中では、
CH3COOHとCH3COO-として50%ずつで存在している、
または、CH3COOHとCH3COO-の存在比が1:1であるともいえる。

酸性物質におけるpHの変化に対する分子形・イオン形の分率・存在比の変化については、下記の別ページで詳しく解説している。
弱酸性物質におけるpHの変化に対する分子形・イオン形の存在比の変化の解説 へ
◆ cについて
c 〇 「ammoniaのpKaは10である」という記述は正しくない。「ammoniumionのpKaは10である」とするべきである。
ある塩基性物質をB:とすると、B:はプロトン(H+)を非共有電子対を介して受け取って陽イオン形(BH+)となり、BH+はプロトンを放出して塩基(B:)に戻る。BH+をB:の共役酸と呼ぶ。
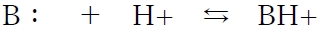
上記の塩基性物質B:の酸塩基平衡について、陽イオン形(BH+)の酸解離定数Kaの式として次が成り立つ。
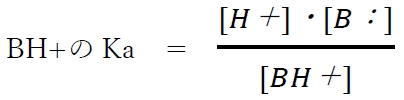
一般に、塩基性物質の酸塩基平衡のKa,pKaといえば、共役酸である陽イオン形(BH+)のKa,pKaのことを指す。
アンモニアについて、次の酸塩基平衡が成り立つ。
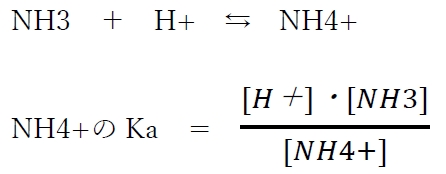
この酸塩基平衡のKa,pKaは、NH3の共役酸であるNH4+(アンモニウムイオン)のKa,pKaのことを指す。
◆ dについて
d 〇 負の値のpKaをもつものは特に強い酸である。
酸解離定数Kaが大きいほど酸性が強く、Kaが小さいほど酸性が弱い。
Kaの負の常用対数(-logKa)をpKaと表し、
pKa =-logKa である。
よって、
Kaが大きいほど,または,pKaが小さいほど酸性が強く、
Kaが小さいほど,または,pKaが大きいほど酸性が弱いことを示す。
pKa値が小さいほど酸性が強いので、負の値のpKaをもつものは特に強い酸だといえる。
なお、塩基性物質の塩基性の強さについて次のことがいえる。
塩基解離定数をKbとすると、
Kbが大きいほど,または,pKbが小さいほど塩基性が強く。
Kbが小さいほど,または,pKbが大きいほど塩基性が強いことを示す。
共役酸のKa,pKaと塩基の塩基性の強さについて、
共役酸の酸性が弱いほど塩基の塩基性は強い。
よって、
共役酸のKaが小さいほど、または、共役酸のpKaが大きいほど塩基性は強い。
共役酸のKaが大きいほど、または、共役酸のpKaが小さいほど塩基性は弱い。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)