この弱酸性化合物の溶解度が1mg/mLとなるpH はいくらか 101回薬剤師国家試験問176
第101回薬剤師国家試験 問176
1価の弱酸性化合物(pKa=6.1)の水に対する溶解度は、pH 1のとき0.1μg/mL であった。
この化合物の溶解度が1mg/mLとなるpH はいくらか。最も近い値を1つ選びなさい。
ただし、イオン形は完全に水に溶解するものとする。
1 2
2 5
3 7
4 10
5 12
第101回薬剤師国家試験 問176 解答解説
正解は4の10である。
1価の弱酸性化合物におけるpHの変化対する溶解度の変化についての問題である。
弱酸性物質におけるpHの変化に対する溶解度の変化の解説 へ
問題は、この弱酸性化合物の溶解度が1mg/mLとなるpH を求めることである。
物質の溶解度は、その物質の飽和溶液における全ての化学種の濃度の総和に等しい。
よって、物質の溶解度について考える時は、飽和溶液を想定する。
・1価の弱酸性物質の飽和溶液の平衡のイメージ

1価の弱電解質の飽和溶液における分子形の濃度とイオン形の濃度を
それぞれ[分子形]飽,[イオン形]飽と表すとすると、1価の弱電解質の溶解度について次式が成り立つ。
1価の弱電解質の溶解度 = [分子形]飽 + [イオン形]飽
上式より、
下記の1価の弱酸性物質の溶解度とpH,pkaの関係式が導かれる。
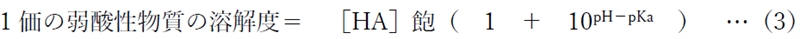
式中の[HA]飽とは、弱酸性物質の分子形の飽和濃度である。
問題文に「1価の弱酸性化合物(pKa=6.1)の水に対する溶解度は、pH 1のとき0.1μg/mL であった」とある。
1価の弱酸性薬物について、pHがpKaより2以上低い値の場合、溶解度は分子形の飽和濃度([HA]飽)にほぼ等しいとみなせる。
よって、この弱酸性化合物の分子形の飽和濃度([HA]飽)は0.1μg/mLであるとわかる。
先ほどの(3)式に、溶解度=1mg/mL,[HA]飽=0.1μg/mL,pKa=6.1を代入して、
pHについて解けばよい。

これを満たすpHは10.1である。
以上より、
pH=10.1の時、この弱酸性化合物の溶解度は1mg/mLとなると考えられる。
なお、このような数式を使ったやり方以外にも、
pH=pKa=6.1の時の溶解度が2×[HA]飽=0.2μg/mLであることから、
それと比較して1mg/mLの溶解度は5000倍なので、
1mg/mLの溶解度はpHがpKaより4ぐらい高い時の溶解度かと感覚的に求めることもできる。
★参考外部サイトリンク
pHおよび解離定数(yakugaku labさん)
★他サイトさんの解説へのリンク
101回問176(e-RECさん)