弱塩基性物質におけるpHの変化に対する分子形・イオン形の存在比(分率)の変化
本ページでは、弱塩基性物質におけるpHの変化に対する分子形とイオン形の存在比(分率)の変化について解説しています。
塩基となる物質(B:)は非共有電子対を供与してプロトン(H+)を受け取って陽イオン形(BH+)となり、BH+はプロトンを放出してB:に戻る。BH+を塩基(B:)の共役酸と呼ぶ。
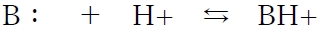
上記の酸塩基平衡より、共役酸BH+の酸解離定数Kaについて次式が成り立つ。
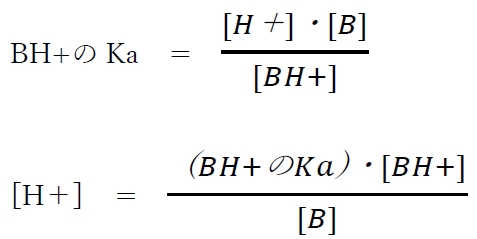
ここで、両辺の負の常用対数をとると、
弱塩基性物質の分子形(B)と陽イオン形(BH+)について、次式が成り立つ。
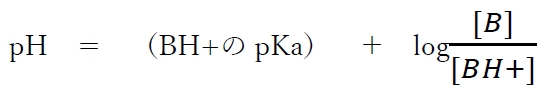
この式は弱塩基性物質Bのヘンダーソン・ハッセルバルヒの式とよばれ。
溶液のpH,BH+のpKa,分子形濃度[B],イオン形濃度[BH+]の関係式として重要である。
この式を変形すると、
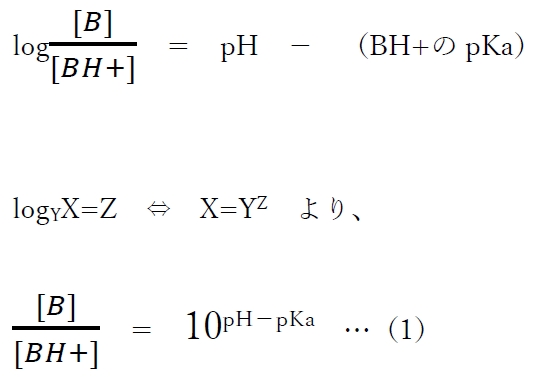
(1)式より、弱塩基性物質のあるpHにおけるB(分子形)とBH+(陽イオン形)の存在割合(存在比)がわかる。
(1)式を用い、弱塩基性物質のpH=pKa−2,pKa−1,pKa,pKa+1,pKa+2の時の分子形Bと陽イオン形BH+の存在割合(存在比)を計算してみる。




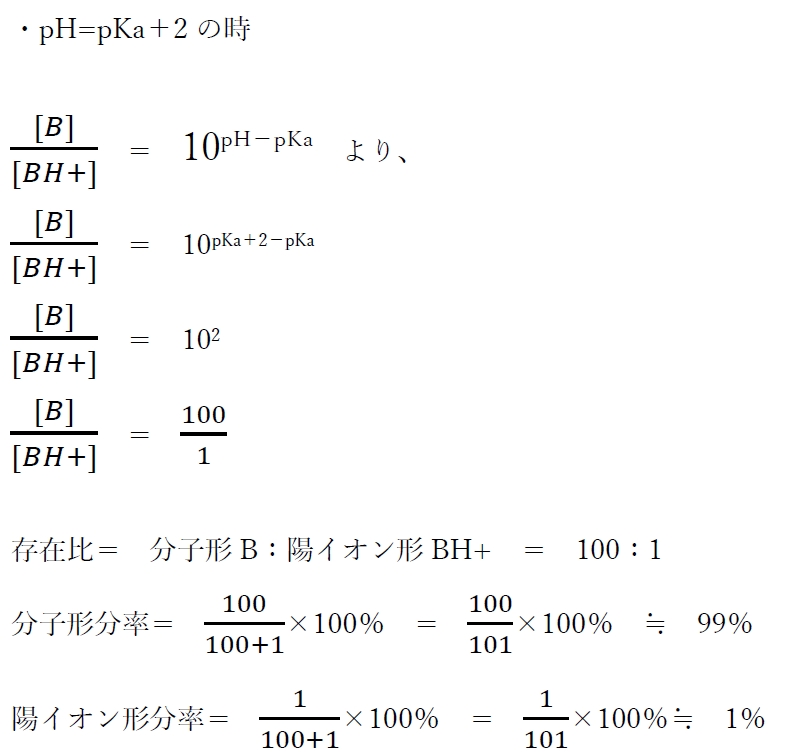
以上より、弱塩基性薬物におけるpHの変化に対する分子形とイオン形の存在比(分率)について、次のように考えられる。
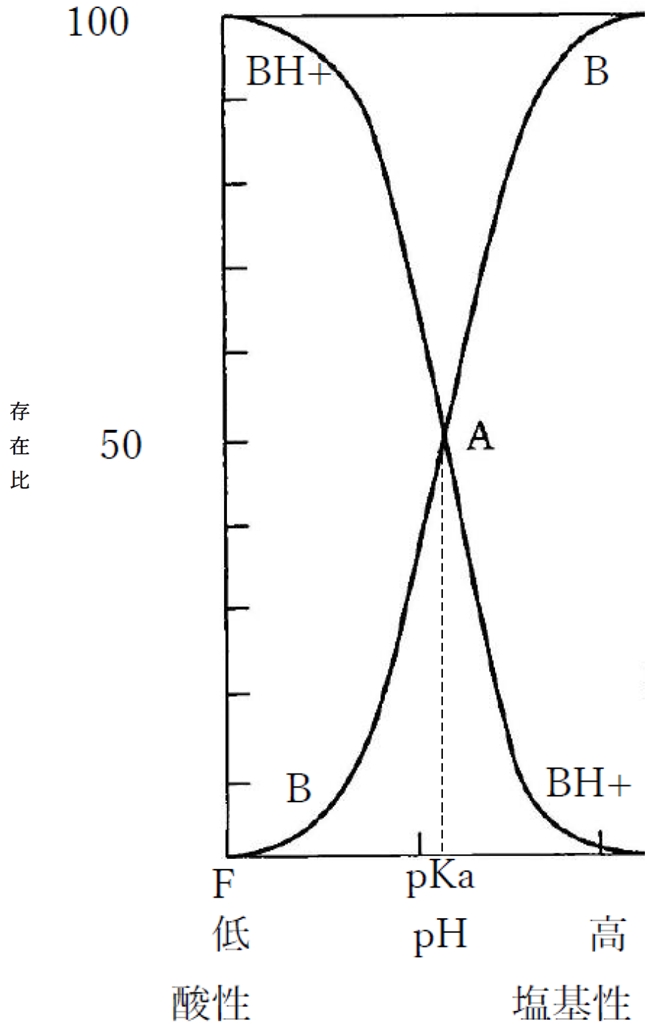
・弱塩基性物質では、pHが上昇するのに伴い、分子形Bの存在割合(存在比)は上昇し、陽イオン形BH+の存在割合(存在比)は低下する。
・弱塩基性物質では、pHが低下するのに伴い、分子形Bの存在割合(存在比)は低下し、陽イオン形BH+の存在割合(存在比)は上昇する。
・pHがBH+のpKaより2以上低い値の場合(pH≦pKa−2)、ほとんど陽イオンBH+で存在している(陽イオン形分率が99%以上)。
・pHがBH+のpKa と等しい場合(pH=pKa)、分子形Bと陽イオン形BH+の存在比は1:1である(分子形と陽イオン形の分率が50%ずつ)。分子形と陽イオン形の濃度が等しい。
・pHがBH+のpKaより2以上高い値の場合(pH≧pKa+2)、ほとんど分子形Bで存在している(分子形分率が99%以上)。
下図は溶液のpHと弱塩基性物質の分子形(B)および陽イオン形(BH+)の存在比の関係を示す曲線である。
なお、弱酸性物質におけるpHの変化に対する分子形・イオン形の分率・存在比の変化については、下記の別ページで解説しているので、併せて参照していただきたい。