88���t���Ǝ�����15 pKa�Ǝ_���CpKb�Ɖ��
��88���t���Ǝ����@��15�@
�𗣒萔�Ɋւ��鉺�L�̋L�q�̐���肵�Ă݂悤�B
a�@pKa�̒l���������قǁA�_���̋����͏������B
b�@pKb�̒l���傫���قǁA����̋����͑傫���B
c�@pKa�̒l�́A�𗣂��Ă��镪�q��Ɖ𗣂��Ă��Ȃ����q�킪�������ʑ��݂��Ă���n�t��pH�ɓ������B
d�@25���ɂ������d�������n�t�ł́ApKa�~pKb��14�Ƃ��Ď�舵����B
e�@pKb 8�̉���́ApH 9�̐��n�t�ɂ����Ă͂قƂ�ǂ��C�I���^�ő��݂��Ă���B
��t���Ǝ����ߋ����W�@�Ȗڕʂ܂Ƃ߈ꗗ�@��
��t���Ǝ����ߋ����W�@�����@�_����t�@��
��88���t���Ǝ����@��15�@���
���@�@a�ɂ���
a�@�~�@pKa�̒l���������قǁA�_���̋����͏������B
���@�Z�@pKa�̒l���������قǁA�_���̋����͑傫���B
�ڍׂ͉��L�̃����N����Q��
88���15a
���@b�ɂ���
b�@�~�@pKb�̒l���傫���قǁA����̋����͑傫���B
���@�Z�@pKb�̒l���������قǁA����̋����͑傫���B
�ڍׂ͉��L�̃����N����Q��
88���15b
���@c�ɂ���
c�@�Z�@pKa�̒l�́A�𗣂��Ă��镪�q��Ɖ𗣂��Ă��Ȃ����q�킪�������ʑ��݂��Ă���n�t��pH�ɓ������B

��L�̎_����t����ɁA
��_�������ɂ��āA�n�t��pH�CHA��pKa�C���q�`�Z�x�mHA�n�C�C�I���`�Z�x�mA�|�n�̊W���Ƃ��āA
���̃w���_�[�\���E�n�b�Z���o���q�̎������藧�B

�����ό`����ƁA
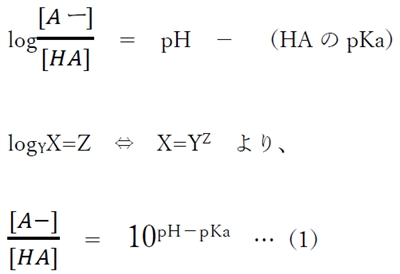
�i1�j�����A��_�������̂���pH�ɂ�����HA�i���q�`�j��A�|�i�A�C�I���`�j�̑��݊����i���ݔ�j���v�Z�ł���B

������ApH=pKa�̎��A���̂��Ƃ����藧�B
���q�`HA�̔Z�x �� �A�C�I���`A�|�̔Z�x
���ݔ� �� ���q�`HA�F�A�C�I���`A�| �� 1�F1
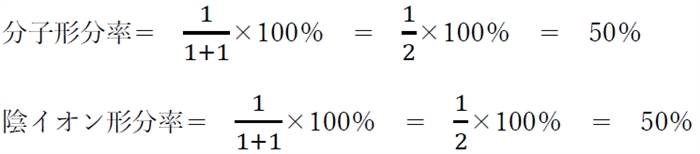
���}��1���̎�_�������ɂ�����n�t��pH�ƕ��q�`�iHA�j����щA�C�I���`�iA�|�j�̑��݊����̊W�������Ȑ��ł���B
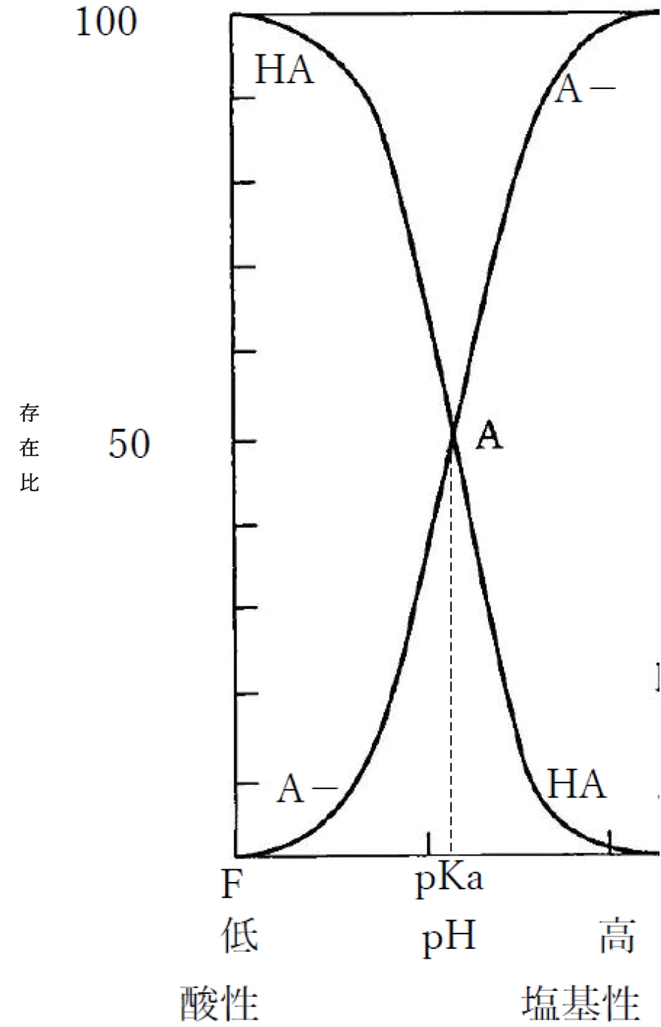
��_�������ɂ�����pH�̕ω��ɑ��镪�q�`�E�C�I���`�̕����E���ݔ�̕ω��ɂ��ẮA���L�̕ʃy�[�W�ŏڂ���������Ă���B
��_�������ɂ�����pH�̕ω��ɑ��镪�q�`�E�C�I���`�̑��ݔ�̕ω��̉���@��
���@d�ɂ���
d�@�~�@25���ɂ������d�������n�t�ł́ApKa�~pKb��14�Ƃ��Ď�舵����B
���@�Z�@25���ɂ������d�������n�t�ł́ApKa�{pKb��14�Ƃ��Ď�舵����B
���̎��ȉ𗣂̕��t�萔�ł��鐅�̃C�I���ρiKw�j�ɂ��āA���������藧�B
���̃C�I���ςɂ��Ă͉��L�̃����N����Q��
���̃C�I���� 82���13b
���̇@�ƇA�̎�_������HA�Ƃ��̋�������A�|�̎_����t�����藧���n�t�ɂ����āA

HA��Ka�A����сA
HA�̋��������A�|��Kb�͎����ŕ\�����B

HA��Ka��
HA�̋��������A�|��Kb���|�����킹��Ǝ��̂悤�ɂȂ�B
�iHA��Ka�j�~�iA�|��Kb�j���mH3O+�n�~�mOH�|�n�� Kw
(HA��Ka) �~ (A�|��Kb) �� Kw�@�ɂ��āA
���ӂ̕��̏�p�ΐ����Ƃ�ƁA
(HA��pKa) + (A�|��pKb) = pKw�@�ƂȂ�B

�ȏ�̂��Ƃ́A
���̇B�ƇC�̎㉖�����B�Ƃ��̋����_��BH+�̎_����t�����藧���n�t�ɂ����Ă����l�ɐ��藧�B

�iBH+��Ka�j�~�iB��Kb�j���mH3O+�n�~�mOH�|�n�� Kw
�iBH+��pKa�j+�iB��pKb�j�� pKw
���@e�ɂ���
e�@�Z�@pKb8�̉���́ApH9�̐��n�t�ɂ����Ă͂قƂ�ǂ��C�I���^�ő��݂��Ă���B
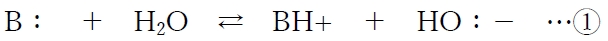
��L�̉���B�F�i���q�`�j�Ƌ����_BH+�i�z�C�I���`�j�̎_����t�ɂ��āA�㉖�����B�F�̃w���_�[�\���E�n�b�Z���o���q�̎��Ƃ��Ď��������藧�B
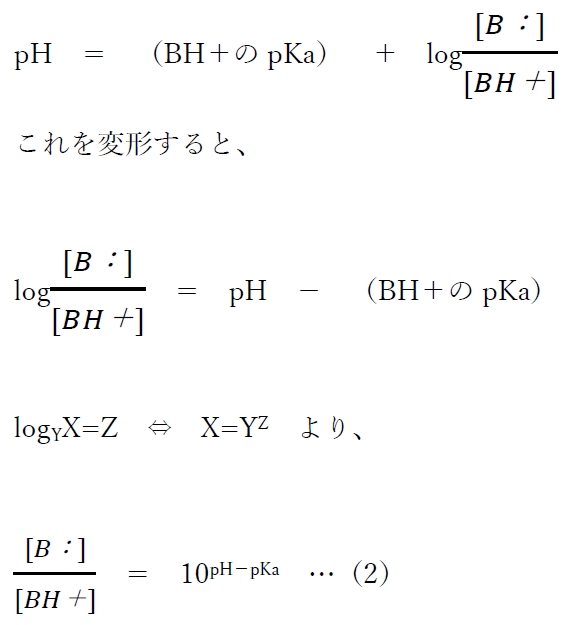
�i2�j���ɁApH��BH�{��pKa��������A����pH�ɂ����镪�q�`B�Ɨz�C�I���`BH+�̑��݊����i���ݔ�j���킩��B

����āApKb 8�̉����B�F�̋����_BH+��pKa�͎�����苁�܂�B
(BH+��pKa) + (B�F��pKb) = 14
(BH+��pKa) + 8 = 14
(BH+��pKa) = 6
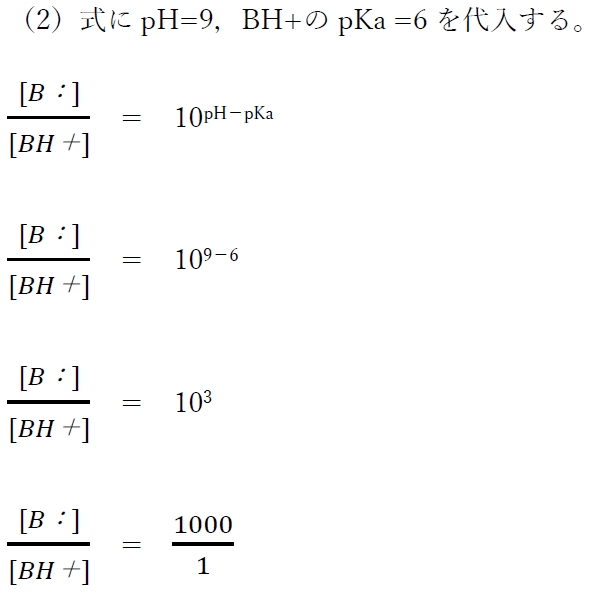
���������āApKb 8�̉����pH 9�̐��n�t�ɂ����镪�q�`�C�C�I���`�̔䗦�ɂ��Ď��̂��Ƃ�������B
���ݔ䁁�@���q�`B�F�z�C�I���`BH+�@���@1�F1000
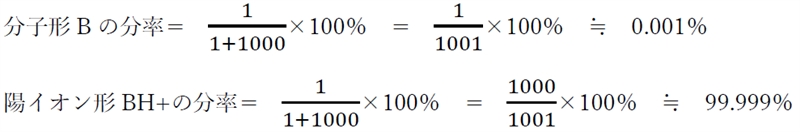
�䂦�ɁApKb 8�̉���́ApH 9�̐��n�t�ɂ����āA�قƂ�ǂ��C�I���`�ő��݂��Ă���ƍl������B
���}�͗n�t��pH�Ǝ㉖������̕��q�`�iB�j����їz�C�I���`�iBH+�j�̑��݊����̊W�������Ȑ��ł���B
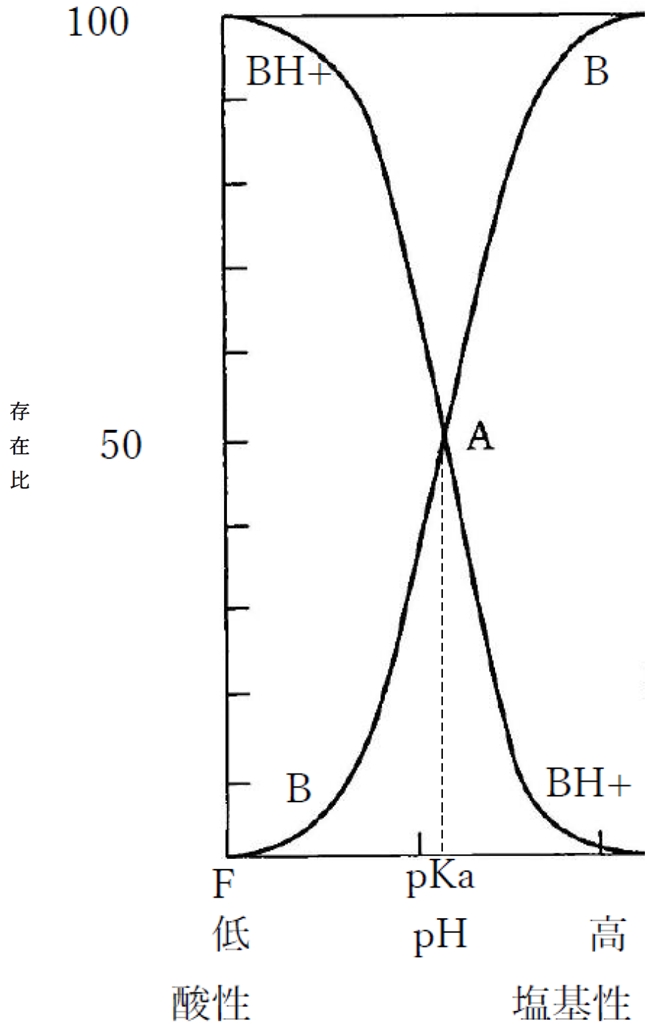
�Ȃ��A�㉖������ɂ�����pH�̕ω��ɑ��镪�q�`�E�C�I���`�̕����E���ݔ�̕ω��ɂ��ẮA���L�̕ʃy�[�W�ʼn�����Ă���B
�㉖������ɂ�����pH�̕ω��ɑ��镪�q�`�E�C�I���`�̑��ݔ�i�����j�̕ω��@��
���Q�l�O���T�C�g�����N
pH����щ𗣒萔�iyakugaku lab����j