Kb,pKbおよび共役酸のka,pKaと塩基性の強さの関係 薬剤師国家試験88回問15b
第88回薬剤師国家試験 問15b
解離定数に関する次の記述の正誤を判定してみよう。
b pKbの値が大きいほど、塩基性の強さは大きい。
第88回薬剤師国家試験 問15b 解答解説
b × pKbの値が大きいほど、塩基性の強さは大きい。
→ 〇 pKbの値が小さいほど、塩基性の強さは大きい。
塩基となる物質(B:)は非共有電子対を供与してプロトン(H+)を受け取って陽イオン形(BH+)となり、BH+はプロトンを放出してB:に戻る。BH+を塩基(B:)の共役酸と呼ぶ。
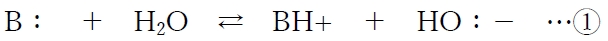
上記の酸塩基平衡の平衡定数をB:の塩基解離定数Kbと呼び、
次式で表される。
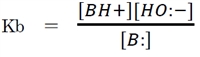
塩基解離定数(Kb)は一定条件下でそれぞれの物質が固有の値を示す。
①の平衡が右に偏り、塩基解離定数(Kb)が大きいほど塩基性が強いことを示す。
また、Kbの負の常用対数(-logKb)をpKbという。
Kbが大きいほど、pKb(-logKb)の値は小さくなるので、
pKbが小さいほどB:の塩基性が強いことを示す。
ただ、実際には物質(B:)の塩基性の強弱を塩基B:のpKbではなく、
B:の共役酸BH+のpKaで示されることが多い。
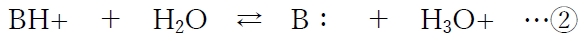
②より、共役酸(BH+)の酸解離定数(Ka)は下記で表される。
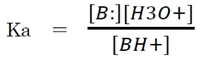
また、共役酸BH+のKaの負の常用対数(-logKa)を、共役酸のpKaという。
共役酸(BH+)の酸性と塩基(B:)の塩基性との関係は下記の通りである。
・共役酸(BH+)のpKaが小さく、共役酸の酸性が強いほど、塩基B:の塩基性は弱い。
・共役酸(BH+)のpKaが大きく、共役酸の酸性が弱いほど、塩基B:の塩基性は強い。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)