アンモニア,ピロリジン,ピリジンの塩基性の比較 薬剤師国家試験95回問4a
第95回薬剤師国家試験 問4a
下記A~Dを塩基性の強いものから並べなさい。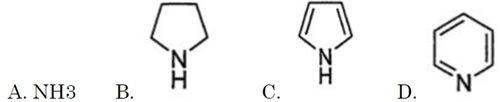
第95回薬剤師国家試験 問4a 解答解説
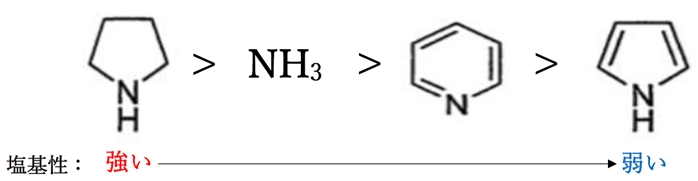
塩基性度の強いものから、
B.ピロリジン >
A.アンモニア >
D.ピリジン >
C.ピロール
である。
物質同士の塩基性の比較のポイントを下記の①~③で示す。
① 非共有電子対がp軌道に収容されて環の芳香族性に寄与する場合、塩基性を示さない

ピロールの窒素原子はsp2混成軌道をとっているが、非共有電子対は2p軌道に入っている。窒素の非共有電子対がp軌道に収容されることで、ピロール環は芳香族性を示し、結果、環は安定なものになっている。よって、ピロールは塩基性を示さない。
② 非共有電子対が入る混成軌道のs性が低いほど塩基性が強い。
詳細は下記のリンク先を参照
非共有電子対の軌道と塩基性 82回問2ab
非共有電子対が入る軌道のs性と塩基性の高さについて、
塩基性の強いものから、sp3>sp2>spとなる。
これを踏まえ、Aのアンモニア,Bのピロリジン,Dのピリジンの塩基性の比較を行う。

AのアンモニアとBのピロリジンの窒素の非共有電子対はsp3に入っているので塩基性が比較的強い。
Dのピリジンの窒素の非共有電子対はsp2混成軌道に入っているので塩基性が比較的弱い。

③ 窒素にアルキル基が結合すると電子供与性電子効果により塩基性が強くなる。
アルキル基は電子供与性の誘起効果を与える。供与可能な非共有電子対を持つ窒素にアルキル基が結合すると、アルキル基の電子供与性電子効果により窒素の電子密度が高まることから、窒素の塩基性が強まる。
ピロリジンでは、窒素に2つのアルキル基が結合しているとみなせる。

よって、ピロリジンでは、アルキル基による電子供与性電子効果で、供与可能な非共有電子対を持つ窒素の電子密度が高まっていることから、無置換のアンモニアよりも窒素の塩基性は強いと考えられる。
★参考外部サイトリンク
酸・塩基の定義(猫でもわかる有機化学さん)