�O�A�j�W���@�����_�̋����艻�Ɖ���@��t���Ǝ���104���7
��104���t���Ǝ����@��7
�ł�����������������͂ǂꂩ�B1�I�тȂ����B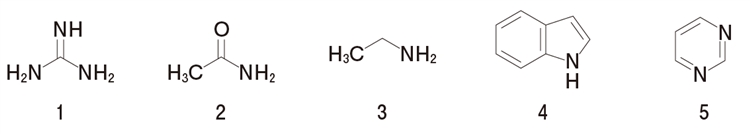
��t���Ǝ����ߋ����W�@�Ȗڕʂ܂Ƃ߈ꗗ�@��
��t���Ǝ����ߋ����W�@���w�@�_���x�E����x�@��
��104���t���Ǝ����@��7�@���
�ł�����������̂�
1�̃O�A�j�W���ł���B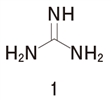
�u�����X�e�b�h�̒�`�ɂ��ƁA����Ƃ�H�{�������̂ł���A����̋����Ƃ�H�{�̎��₷���̂��Ƃł���B
����ƂȂ镨���iB�F�j�̓v���g���iH+�j������ėz�C�I���`�iBH+�j�ƂȂ�ABH+�̓v���g������o����B�F�ɖ߂�B
BH+������iB�F�j�̋����_�ƌĂԁB

���@�����_�iBH+�j�̈��萫�������قǁA����iB�F�j�̉���͋����B

�ܒ��f�������̋����_�Ƃ́A���f�iN�F�j��H�{�������NH�{�ɂȂ����z�C�I���̂��Ƃł���B
�����_�iNH�{�j�́A���ɂ�萳�d�ׂ��L�����U����قLj��萫�������B
�O�A�j�W���̋����_�iNH�{�j�́A���ɂ�萳�d�ׂ�3�̒��f�ɔ�Ǎ݉������̂ŁA���Ȃ���萫�������B
����āA�O�A�j�W���̉���͂��Ȃ苭���B

���̑I�����ɂ���
���@�Q�ɂ���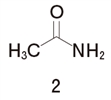
���@�A�~�h�̒��f�͉���������Ȃ��B
�ڍׂ͉��L�̃����N����Q��
�A�~�h�̒��f�͉���������Ȃ��@85���14a
���@�R�ɂ���
�G�`���A�~���̒��f�̔L�d�q��s���̒Ⴂsp3�Ɏ��e����Ă���A����ɁA�A���L����ɂ��d�q���^���d�q���ʂŒ��f�̓d�q���x�����߂��Ă��邱�Ƃ���A�G�`���A�~���̉���͔�r�I�ɋ����B

�����A�����_�iNH�{�j�̐��d�ׂ����ɂ���ĕ��U���Ȃ����߁A1�̃O�A�j�W���Ƃ̔�r�ł͑��ΓI�ɉ���͎ア�B
���@���f�̔L�d�q�����鍬���O����s�����Ⴂ�قlj���������B
�ڍׂ͉��L�̃����N����Q��
�L�d�q�̋O���Ɖ�� 82���2ab
���@���f�ɃA���L�����������Ɠd�q���^���d�q���ʂɂ�艖��������Ȃ�B
�A���L����͓d�q���^���̗U�N���ʂ�����B���^�\�ȔL�d�q�������f�ɃA���L�����������ƁA���f�̓d�q���x�����܂�L�d�q�����^���₷���Ȃ邱�Ƃ���A���f�̉�������܂�
���@�S�ɂ���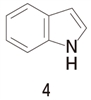
�C���h�[���̒��f�͉���������Ȃ��B
���@�@�̒��f�̔L�d�q��p�O���Ɏ��e����A�̖F�������Ɋ�^���Ă���ꍇ�A���̒��f�͉���������Ȃ�
�C���h�[���ł́A���f�̔L�d�q��p�O���Ɏ��e����邱�ƂŁA�͖F�������������A���ʁA�͈���Ȃ��̂ɂȂ��Ă���B����āA�C���h�[���͉���������Ȃ��B

���@�T�ɂ���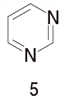
�s���~�W����2�̒��f�̔L�d�q��sp2�����O���Ɏ��e����Ă��艖����������A���̉���͎ア�B

���Q�l�O���T�C�g�����N
�ܒ��f�������̉���x�i��w�����OK�I����j
����̋���i�L�ł��킩��L�@���w����j
�����T�C�g����̉���ւ̃����N
��104���7�ie-REC����j