クロロホルムとアセトンの気相−液相の状態図 96回薬剤師国家試験問19
96回薬剤師国家試験 問19
図はクロロホルムとアセトンの混合系の気相−液相の状態図である。圧力(1気圧)一定で、横軸は組成(クロロホルムのモル分率)、縦軸は温度である。この混合系に関する記述のうち、正しいものはどれか。

a 曲線 ABC 及び曲線 CDE は沸騰曲線である。
b 相の数をP、相律の系の自由度をFとすると、F = 3−P である。
c クロロホルムのモル分率が0.35の混合物は、分留によって共沸混合物とクロロホルムに分けられる。
d クロロホルムとアセトンを混合すると発熱する。
96回薬剤師国家試験 問19 解答解説
◆ aについて
a 〇 曲線 ABC 及び曲線 CDE は沸騰曲線である。
図の曲線AC及びCEは気相線(凝縮曲線)であり、
曲線 ABC 及びCDE は液相線(沸騰曲線または蒸発曲線)である。
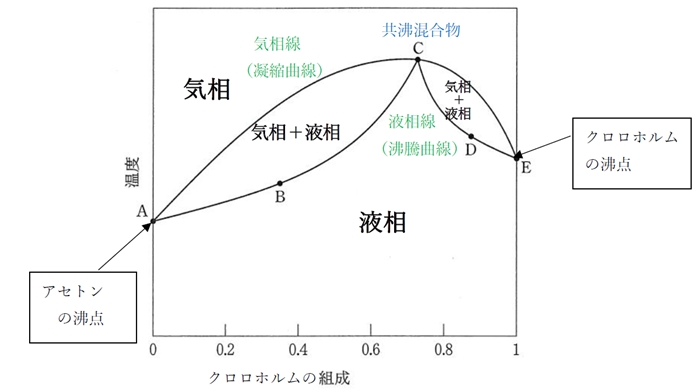
点Cは気相線の極大点と液相線の交点である。
点Cの組成の混合物は共沸混合物と呼ばれ、蒸発(沸騰)または凝縮した際に気相と液相の組成が等しくなる。
本問の図のように、共沸混合物を生成する二成分系の気−液平衡の状態図は、
気相線に極大沸点または極小沸点がある。
◆ bについて
b × 相の数をP、相律の系の自由度をFとすると、F = 3−P である。
→ 〇 相の数をP、相律の系の自由度をFとすると、F =4−P である。
自由度(F)とは、
相の数を維持するのに自由に決定できる示強性状態関数(温度・圧力など)の数である。
ギブズの相律によると、
自由度(F)は次式で計算される。
F = C−P+2
(C:成分の数 P:相の数)
本問は二成分系なのでC=2であり、
F = C−P+2 より、
F = 2−P+2
F = 4−P
となる。
◆ cについて
c × クロロホルムのモル分率が0.35の混合物は、分留によって共沸混合物とクロロホルムに分けられる。
→ 〇 クロロホルムのモル分率が0.35の混合物は、分留によって共沸混合物とアセトンに分けられる。
始点のクロロホルムの組成が共沸混合物のクロロホルムの組成よりも小さい場合、
分留を繰り返すと、下の図のように共沸混合物とアセトンに分けられることになる。

なお、点Dのように始点のクロロホルムの組成が共沸混合物のクロロホルムの組成よりも大きい場合、
分留を繰り返すと、下の図のように共沸混合物とクロロホルムに分けられることになる。

◆ dについて
d 〇 クロロホルムとアセトンを混合すると発熱する。
同種分子間の相互作用よりも異種分子間の相互作用の方が強い場合、
異種分子同士の混合が進むほど、液相が安定化して蒸気圧は低くなり、
蒸気圧曲線(液相線)には極小点が見られ、気相線には極大点が見られる。
混合すると安定化するということは、混合前よりも混合後の方がエネルギーは低いということであり、
そのエネルギー差の分を熱として放出する(発熱する)ことになる。
本問のクロロホルムとアセトンの状態図では、
蒸気圧曲線(液相線)には極小点が見られ、気相線には極大点が見られるので、上記のことが該当する。

反対に、異種分子間の相互作用よりも同種分子間の相互作用の方が強い場合、
異種分子同士の混合が進むほど、液相が不安定となり、気化が進むため蒸気圧が高くなり、
蒸気圧曲線(液相線)には極大点が見られ、気相線には極小点が見られる。