質量分析 同位体イオンピークとは
本ページでは、質量分析法のマススペクトルにおける同位体イオンピークについて説明しています。
12C,14N,16Oなどの天然同位体存在比の最も高い核種のみで構成されるモノアイソトピックイオンM+に対して、
1〜2マスユニット間隔で並ぶ[M+1]+及び [M+2]+などのピークは、
天然同位体存在比の最も高い核種以外の安定同位体である13C,15N,18Oなどを含むイオンのピークであり、同位体イオンピークと呼ばれる。
分子が各安定同位体を含む確率は天然同位体存在比に従う。
よって、分子式が同じであれば、分子イオンにおいて、
モノアイソトピックイオンM+と[M+1]+及び [M+2]+などの同位体イオンのピークの相対強度の比はほぼ等しくなる。
下記はEI法における酢酸ベンジル(分子式C9H10O2)の分子イオンにおけるモノアイソトピックイオンと同位体イオンのピークである。
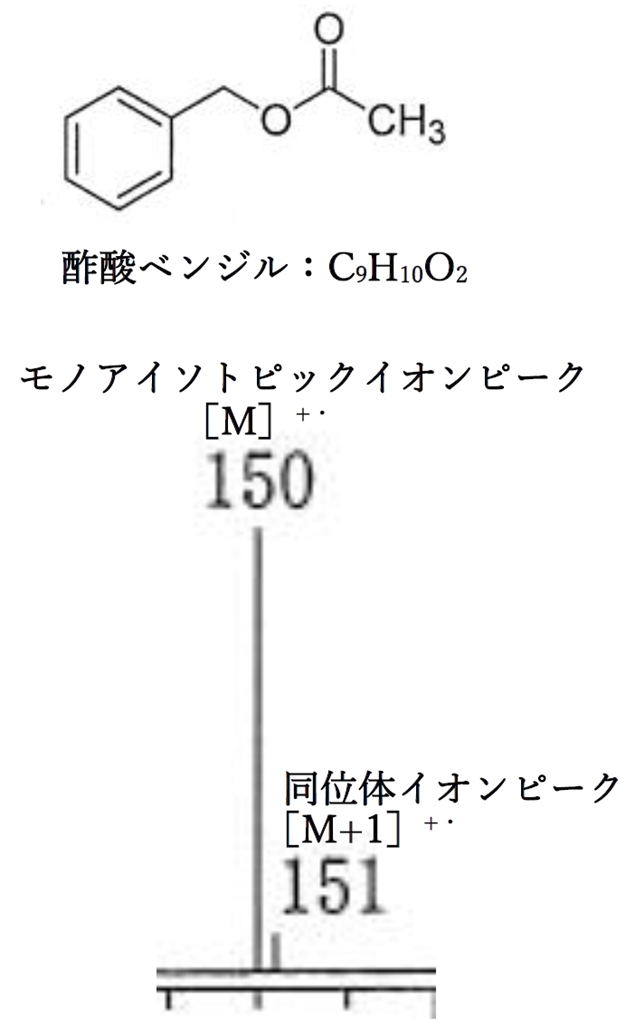
分子式C9H10O2の他の化合物でも、
モノアイソトピックイオンと同位体イオンのピークの相対強度の比は上記とほぼ等しい。
このことは、モノアイソトピックイオンと同位体イオンのピークの相対強度の比のパターンから分子式を推定できることにつながる。
ハロゲンの塩素や臭素が含まれる場合、
同位体イオンピークの相対強度の比が特徴的である。
詳細は下記のリンク先を参照
臭素を含む場合の同位体ピーク