メトキシベンゼン(アニソール)Aの一般的な合成法 ウイリアムソンのエーテル合成 99回問103
第99回薬剤師国家試験 問103
メトキシベンゼン(アニソール)Aの一般的な合成法を以下に示した。これに関する記述の正誤を判定してみよう。

1 SN2機構で進行する。
2 カルボカチオン中間体を経由して進行する。
3 ヨードメタン(C)の代わりにCH3SO3CH3を利用することができる。
4 プロトン性極性溶媒を使用すると反応が速く進行する。
5 Aは、下記のDとEから合成することも可能である。
第99回薬剤師国家試験 問103 解答解説

★ ウイリアムソンのエーテル合成
本問の反応は立体障害の小さいハロゲン化合物を基質としてSN2機構で進行するエーテルの合成法であり、
ウイリアムソンのエーテル合成と呼ばれる。
立体障害の小さいハロゲン−sp3炭素の構造を有するハロゲン化合物を基質とし、
ハロゲン−sp3炭素のCδ+に対してアルコキシドイオン(RO:−)やフェノキシドイオン(Ph−O:−)が脱離基であるハロゲンのいない側から求核攻撃を行い付加すると同時にハロゲンが陰イオンとなって脱離するという反応が一段階で起こる。
このSN2反応により、ハロゲンとアルコキシド(RO)またはフェノキシド(Ph−O)が置換したエーテルが生成する。
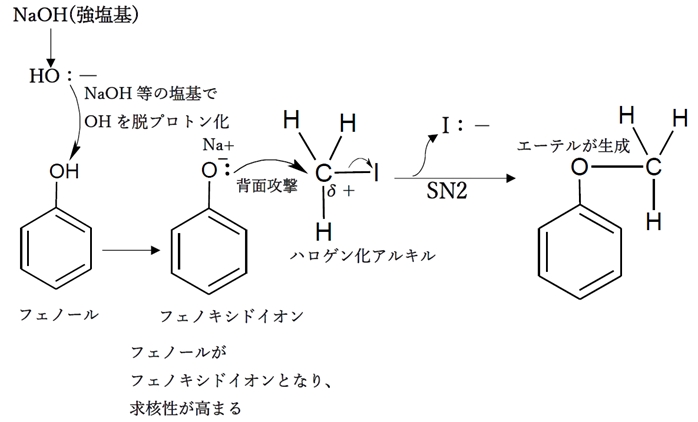
アルコール(R−OH)やフェノール性ヒドロキシ基(Ph−OH)は分子形のままでは求核性が低いので、
強塩基を反応させて脱プロトン化し、
アルコキシドイオン(R−O:-)やフェノキシドイオン(Ph−O:-)にして求核性を高める必要がある。
◆ 1について
1 〇 SN2機構で進行する。
設問の反応の基質は臭化メチルである。
臭化メチルは反応中心炭素の立体障害の小さい基質であり、Cδ+に求核剤がアクセスしやすいので、SN2反応が起こりやすい。よって、設問の反応はSN2機構で進行すると考えられる。
仮にSN1機構で進行したとすると、臭化メチルから臭素が脱離してメチルカチオン中間体を経由する過程を経ることになるが、メチルカチオンはカルボカチオンとして不安定なためこの過程が進行しにくいと考えられる。よって、設問の反応がカルボカチオン中間体を経由するSN1機構で進行した可能性は低い。

SN1とSN2の基質と反応性の関係については
下記のリンク先を参照
SN1・SN2の基質の構造と反応性 83回問7c
◆ 2について
2 × カルボカチオン中間体を経由して進行する。
本問のウィリアムソンのエーテル合成はSN2反応である。
SN2反応は、求核剤が付加すると同時に脱離基が外れるという一段階の反応であり、カルボカチオン中間体を経由しない。
なお、SN1反応はカルボカチオン中間体を経由する。
◆ 3について

3 〇 ヨードメタン(C)の代わりにCH3SO3CH3を利用することができる。
★ 置換反応と脱離反応では、基質から外れた後の脱離基の安定性が高いほど、基質から脱離基が外れやすく、反応が起こりやすいといえる。
求核置換反応であるSN1とSN2では基質から脱離基が外れ、脱離基の分子または陰イオン(アニオン)が生成する。よって、脱離基が外れた後に生成する化学種の安定性が高いほど求核置換反応は起こりやすい。
CH3SO3CH3を基質として設問のSN2反応が起こると仮定すると、脱離基としてCH3SO3 2−が生成する。
スルホン酸アニオン(R−SO3 2−)は安定性の高いアニオンなので、この反応は起こりやすいと考えられる。

◆ 4について
4 × プロトン性極性溶媒を使用すると反応が速く進行する。
→ 〇 SN2反応でプロトン性溶媒を用いると、求核試薬が溶媒和されて求核性が低下するため、反応が遅くなる。一方、SN2反応で非プロトン性極性溶媒を使用すると反応が比較的に速く進行する。
詳細は下記のリンク先を参照
求核置換置換反応(SN1,SN2)の溶媒と反応性の関係
◆ 5について

5 × Aは、DとEから合成することも可能である。

★ ハロゲン化ビニル(CH2=CH−X)とハロゲン化アリール(Ar−X)では求核置換反応が起こりにくい。

詳細は下記のリンク先を参照
ハロゲン化アリールは求核置換反応で不活性 83回問7d
★他サイトさんの解説へのリンク
第99回問103(e-RECさん)