ギブズエネルギーの温度依存性 94回薬剤師国家試験問18bd
94回薬剤師国家試験 問18bd
ギブズエネルギーに関する記述の正誤を判定してみよう。
b ギブズエネルギーは、圧力一定の条件下では温度の上昇に伴って増加する。
d 純物質は、その沸点で液相と気相のモルギブズエネルギーが等しい。
94回薬剤師国家試験 問18bd 解答解説
b 〇 ギブズエネルギーは、圧力一定の条件下では温度の上昇に伴って増加する。
d 〇 純物質は、その沸点で液相と気相のモルギブズエネルギーが等しい。
沸点では液相と気相の化学ポテンシャルが等しい。
純物質(一成分系)に限り、化学ポテンシャル=モルギブズエネルギーなので、
純物質は、その沸点で液相と気相のモルギブズエネルギーが等しいといえる。
★ ギブズエネルギー(G)の温度依存性
閉鎖系においては、
系のギブズエネルギー(G)の温度・圧力依存性について、
次式が成り立つ。
dG = V・dp - S・dT …①
(dは微小変化を表す)
dG:ギブズエネルギーの微小変化
V:体積 dp:圧力の微小変化
S:エントロピー dT:温度の微小変化
定圧条件下では、dp=0であるので、
dG = -S・dT …②
となる。
②式より、
ギブズエネルギーは、圧力一定の条件下では温度の上昇に伴って増加するといえる。
②式を変形すると、次の③式となる。
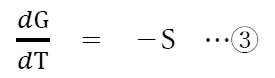
系が純物質(一成分系)の場合、
③式を1mol当たりの量で考えると、次の④式となる。
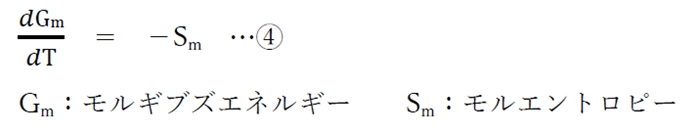
系が純物質(一成分系)の場合に限り、
モルギブズエネルギー = 化学ポテンシャル(μ:ミュー)
であるので、④式より、次の⑤式が成り立つ。
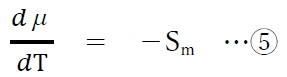
⑤式は
単位温度変化に対する化学ポテンシャルの変化は、
モルエントロピーに等しいことを示す。
下の図は、純物質(一成分系)における、
温度と化学ポテンシャル(純物質ならモルギブズエネルギー)の関係を示す。
系は化学ポテンシャルの小さい状態になろうとするので、
温度変化に伴い、グラフの実線に沿って物理的状態が変化する。

なお、化学ポテンシャルは、本来、部分モルギブズエネルギーであることに注意する
(モルギブズエネルギーと部分モルギブズエネルギーは異なる)。
化学ポテンシャル = モルギブズエネルギー
が成り立つのは、系が純物質(一成分系)の場合に限定される。
化学ポテンシャルについては下記のリンク先を参照
化学プテンシャルとは